题目内容
【题目】B、C、D、E分别是初中化学常见的四种不同的氧化物(或过氧化物)。B、C由相同的元素组成,常温下呈液态,且C的相对分子质量比B的大;D、E是常见的黑色固体。“→”表示物质间的转化关系。请回答: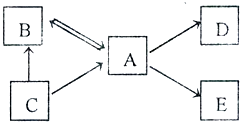
(1)写出C的化学式
(2)若A→D时的实验现象为剧烈燃烧、火星四射。则D的化学式为。
(3)若A和单质铜在加热条件下反应生成E,写出该反应的文字表达式。
【答案】
(1)H2O2
(2)Fe3O4
(3)铜 + 氧气 ![]() 氧化铜
氧化铜
【解析】B、C由相同的元素组成,常温下呈液态,B、C为氧化物,可推知B、C中的一种是水,一种是过氧化氢溶液,且C的相对分子质量比B的大,所以可以确定B为水,C为过氧化氢;B和C都可以转化为A,水在通电的条件下,生成氢气和氧气;过氧化氢在二氧化锰的催化作用下生成水和氧气,所以A为氧气;D、E是常见的黑色固体,且为氧化物,所以常见的黑色固体中属于氧化物的由四氧化三铁和氧化铜,根据题意,A→D时的实验现象为剧烈燃烧、火星四射,说明D是四氧化三铁,A和单质铜在加热条件下反应生成E,E是氧化铜。经代入检验,符合题意,推断正确。所以(1)C的化学式为H2O2;(2)D的化学式为Fe3O4;(3)铜和氧气在加热的条件下反应的文字表达式为:铜 + 氧气 ![]() 氧化铜。
氧化铜。
【考点精析】通过灵活运用书写化学方程式、文字表达式、电离方程式,掌握注意:a、配平 b、条件 c、箭号即可以解答此题.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案【题目】向硫酸亚铁和硫酸铜的混合溶液中加入一些铝粉,充分反应后过滤,得到固体不溶物M和滤液则M的组成不可能是( )
A. 只含有CuB. 只含有Fe、Cu
C. 只含有Al、CuD. 含有Al、Fe、Cu
【题目】探究学习小组在实验室中用图1所示装置制取CO2并探究CO2与过氧化钠(Na2O2)的反应.
查阅资料得知:过氧化钠(Na2O2)是一种淡黄色固体,能与CO2 , H2O发生反应:Na2O2+2CO2═2Na2CO3+O2 , 2Na2O2+H2O═4NaOH+O2↑
请回答下列问题:
(1)装置A中发生反应的化学方程式为 , 利用装置A制取CO2的优点是 .
(2)装置B的作用是吸收CO2中混有的HCl,发生反应化学方程式为
(3)装置D的作用是 .
(4)装置E中收集到的气体是(填化学式),该气体还可以用下列图2装置中的进行收集(填写字母序号).
(5)为探究反应后装置C硬质玻璃管中固体的成分,该小组同学进行了如图3实验: 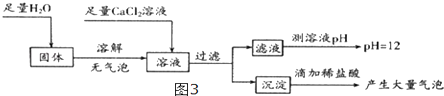
根据固体加水溶解无气泡,得_结论,加入足量氯化钙目的为 , 根据判断,反应后装置C硬质玻璃管中固体为 .
(6)①在实验室制取二氧化碳的研究中,探究学习小组又进行了如下实验:
药品编号 | 甲 | 乙 | 丙 | 丁 |
大理石 | m g,块状 | m g,块状 | m g,粉末状 | m g,粉末状 |
盐酸(过量) | w g,稀盐酸 | w g,浓盐酸 | w g,稀盐酸 | w g,浓盐酸 |
I.若要研究盐酸浓度大小对反应的影响,可选择实验甲与对照(选填实验编号)。
II..除盐酸的浓度外,上述实验研究的另一个影响反应的因素是。
III.研究发现酸的浓度越大,产生气体的速度越快,与甲比较,对丁分析正确的是选填编号)
A、反应更为剧烈 B、最终剩余溶液的质量更小
C、产生的二氧化碳的质量更大 D、粉末状大理石利用率更高
②下表中的两个实验,尽管在原料状态、发生装置等方面存在差异,却都能控制气体较平稳地产生。请从实验目的、原理、原料、装置、操作等方面思考后,具体阐述每个实验中气体较平稳产生的最主要的一个原因。
目的 | 原料 | 发生装置 | 气体较平稳产生的 |
制取二氧化碳 | 块状大理石稀盐酸 | A | |
制取氧气 | 粉末状二氧化碳3%的过氧化氢溶液 | F |