题目内容
(2005?益阳)某石灰厂煅烧石灰石生产生石灰,若生产l 008t生石灰,需要含碳酸钙90%的石灰石的质量为(相对原子质量:Ca-40、C-12、O-16)( )
【答案】分析:据反应的化学方程式计算出生产1008t生石灰时分解碳酸钙的质量,再根据石灰石中含碳酸钙为90%,由碳酸钙的质量计算石灰石的质量.
解答:解:设需要含碳酸钙90%的石灰石的质量为x
CaCO3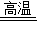 CaO+CO2↑
CaO+CO2↑
100 56
x×90% 1008t
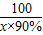 =
=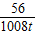
x=2000t
故选D.
点评:根据化学方程式进行计算时,所使用的物质的质量必须都是纯净物的质量,不能把含杂质的物质的质量直接代入方程式进行计算.
解答:解:设需要含碳酸钙90%的石灰石的质量为x
CaCO3
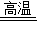 CaO+CO2↑
CaO+CO2↑100 56
x×90% 1008t
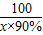 =
=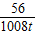
x=2000t
故选D.
点评:根据化学方程式进行计算时,所使用的物质的质量必须都是纯净物的质量,不能把含杂质的物质的质量直接代入方程式进行计算.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
