题目内容
取含Na2CO3和NaCl的样品34g放在烧杯中并滴入稀盐酸,当稀盐酸滴加至146g时,恰好完全反应,此时,烧杯内溶液的总质量为175.6g。计算样品中钠元素和氯元素的质量比。
Na2CO3与稀盐酸反应生成二氧化碳的质量为34+146-175.6=4.4克,
设碳酸钠的质量为x.
Na2CO3+2HCl→2NaCl+ H2O+CO2↑
106 44
X 4.4g
106/44=X/4.4g
解得X=10.6g,
则氯化钠的质量为34-10.6克=23.4g,
样品中钠元素质量为10.6*46/106+23.4*23/58.5=13.8g
样品中氯元素质量为23.4g*35.5/58.5=14.2g,所以
样品中钠元素和氯元素的质量比=13.8/14.2=69:71
设碳酸钠的质量为x.
Na2CO3+2HCl→2NaCl+ H2O+CO2↑
106 44
X 4.4g
106/44=X/4.4g
解得X=10.6g,
则氯化钠的质量为34-10.6克=23.4g,
样品中钠元素质量为10.6*46/106+23.4*23/58.5=13.8g
样品中氯元素质量为23.4g*35.5/58.5=14.2g,所以
样品中钠元素和氯元素的质量比=13.8/14.2=69:71
通过反应前后的质量差34+146-175.6=4.4克,就是二氧化碳的质量,根据二氧化碳的质量可以求出碳酸钠的质量,从而求出氯化钠的质量,然后钠元素和氯元素的质量比就可以求出来了。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

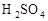
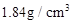 质量分数:98%
质量分数:98%