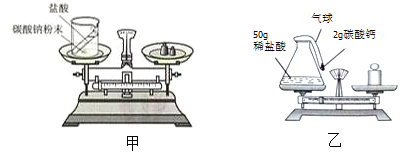
��Ŀ����
����Ŀ��ij��ѧ��ȤС��Ϳ����������ĺ�������ʵ��̽����
(1)ͬѧ�ǽ������ۺ���Ϊ��ѡ���ҩƷ��Ҫ�������������ֲ���������е������ɷַ�Ӧ������������Ϊ���塣����Ӧ��ѡ��_____________(����)��
A������ B������ C����˿
Ϊ�˳�����������е�������ҩƷ������Ӧ��֤__________________________��
(2)С��ͬѧ��ͬ���������ͼ������װ�ã�����Ϊ��������___________(����)��
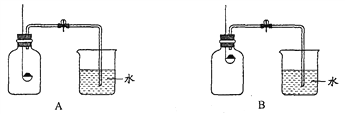
Ϊ��ȷ��ʵ��ijɹ�����װҩƷ֮ǰӦ��____________________________________��
���ۺ����Ƿ��������ʵ�顣ʵ������������������£�(ע������ƿ�ݻ�Ϊ100 mL)
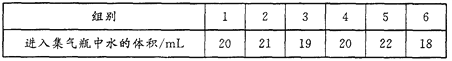
(3)ͨ����ʵ�����Ľ����������ͬѧ����֤������Լռ���������___________��
ͨ��ʵ�黹�����ƶϼ���ƿ��ʣ�������������_____________________________��
(4)С���ͬѧ����ʵ����ֳ�����ľ̿������������ʵ�飬����ˮ����û�н��뼯��ƿ�������ۣ�ͬѧ��һ����Ϊ��������ڼ���ƿ��ע������___________��Һ������____________���壬ʵ��Ҳ��ȡ�ýϺõ�Ч����
���𰸡� B ���� A ���װ�������� l��5 ��ɫ��ζ�����壬������ˮ������ȼ��Ҳ��֧��һ���ȼ���ȼ�� �������� ������̼
��������(1)����Ҫ�������������ֲ���������е������ɷַ�Ӧ����������������������Ϊ��������ȼ���������壬��˿����������е�����Ѹ�ٷ�Ӧ��Ϊ�˳�����������е�������ҩƷ������Ӧ��֤������(2)Aװ����ȼ�ճ�λ�ÿ���һЩ���ܳ�ֽ������ڵ�������Ӧ������Ϊ������Ϊ��ȷ��ʵ��ijɹ�����װҩƷ֮ǰӦ���ȼ��װ�������ԣ�(3) �ⶨ����������������ԭ���ǣ���������������е�������Ӧ���ֲ��������壬ʹƿ������� �٣�ѹǿ��С��ˮ�����뼯��ƿ�ڣ�������ˮ������͵���ƿ�������������ʵ���е�����ˮԼռ����ƿ�ݻ������֮һ��֤������Լռ������������֮һ��ͨ��ʵ�黹�����ƶϵ����������Dz���ȼ����ȼ��������ˮ������ˮ��Ӧ��(4)��ľ̿����ʵ�飬�������ɶ�����̼��ˮ����û�н��뼯��ƿ�����Ƕ�����̼��������������Һ��Ӧ����̼���ƺ�ˮ�������������ڼ���ƿ��ע����������������Һ�����ն�����̼���壬ʵ��Ҳ��ȡ�ýϺõ�Ч����

 ��������ϵ�д�
��������ϵ�д� ����˼ά����ѵ����ʱ��ѧ��ϵ�д�
����˼ά����ѵ����ʱ��ѧ��ϵ�д�����Ŀ��ij��ѧʵ��С��ԡ�Ӱ��ʯ��ʯ�����ᷴӦ���ʵ����ة��������Ũ�Ⱥ�ʯ��ʯ�Ŀ�����С�ȡ�����������ʵ��̽����������룮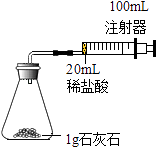
[����ʵ��]
�����£�ѡ��20mL��ͬ�����������������ᣨ4%��6%���ֱ���1g����״���״��ʯ��ʯ����ʵ�飨�̶��г�������ȥ����
��1��ʯ��ʯ�����ᷴӦ�Ļ�ѧ����ʽΪ ��
��2������ͼװ�ý���ʵ�飬��װҩƷǰӦ����װ�õ������ԣ������������ �� ��ʼʵ��ʱ��Ӧ��20mLϡ������ѡ����١���������������ƿ�У��Ա�֤������ȫ��������ƿ�У�
��3��[��������]
ʵ��С�����ʵ���õ����ʵ�����������ʾ��
ʵ���� | ���������������� | ʯ��ʯ������״ | ������̼�����mL�� |
a | 4% | ���� | 64.0 |
b | 4% | ��״ | 40.4 |
c | 6% | ���� | 98.2 |
d | 6% | ��״ | 65.3 |
��Ҫ�Ƚ���дһ�飩���ɴ˿ɵõ��Ľ����� ��
�ڴ�����ʵ���еó�ʯ��ʯ�Ŀ�����С��Ӧ����Ӱ��Ľ����� ��
��4��[��չ����]
�����ʵ��ʱ��¼���ɵĶ�����̼��������Ͷ�Ӧ��ʱ���һ��ʵ�����ݣ�ÿ���4S����һ�Σ���
ʱ��/S | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 | 36 | 40 |
�������/mL | 16.0 | 22.2 | 29.4 | 39.3 | 50.4 | 57.6 | 62.0 | 64.7 | 66.0 | 66.0 |
���ϱ����ݿ��Է����ó�����20S��Ӧ������ �� ����Ҫԭ���� ��
��5������ΪӰ��ʯ��ʯ�����ᷴӦ���ʵ����ػ��� �� �����ʵ�鷽����֤��IJ���