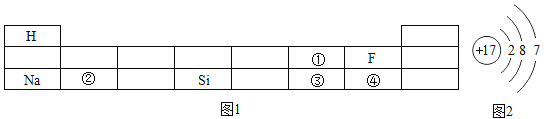
题目内容
【题目】黄铜矿(主要成分为CuFeS2)经初步处理后,所得溶液甲中的溶质为Fe2(SO4)3,CuSO4及H2SO4.某同学通过废铁屑与溶液甲反应,制取补血剂原料碳酸亚铁并回收铜。主要步骤如图所示:
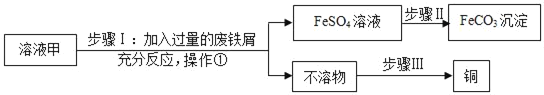
(1)操作①的名称是_____。
(2)步骤I中,生成铜的化学方程式:_____。
(3)步骤Ⅱ中加入一种可溶性试剂可实现其转化,从复分解反应发生的条件分析,该试剂可以是_____(填化学式)。
(4)步骤Ⅲ回收铜的方法步骤为_____、_____、_____、_____。
【答案】过滤 Fe+CuSO4=FeSO4+Cu Na2CO3或者K2CO3等可溶性碳酸盐 加入过量的稀盐酸或者稀硫酸 过滤 洗涤 干燥
【解析】
(1)操作①得到硫酸亚铁溶液和不溶性物质,分离的液体和固体,所以过滤;
(2)由于溶液甲中的溶质为Fe2(SO4)3,CuSO4及H2SO4.所以步骤I中,铁和硫酸铜反应生成硫酸亚铁和铜,对应生成铜的化学方程式:Fe+CuSO4=FeSO4+Cu;
(3)步骤Ⅱ中加入一种可溶性试剂可实现其转化,从复分解反应发生的条件分析,是两种盐类反应且生成物含有碳酸根,所以应该是可溶性碳酸盐,对应试剂可以是 Na2CO3或者K2CO3等可溶性碳酸盐;
(4)步骤Ⅲ是从铜铁混合物回收铜,所以需要将铁反应掉,所以加入过量的酸将之除掉,然后过滤、洗涤干燥,具体的方法步骤为加入过量的稀盐酸或者稀硫酸、过滤、洗涤、干燥。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】用如图实验装置制取干燥的气体,完全确的一组是( ),
物质 物质 选项 | A | B | C | D |
X | 大理石与稀盐酸 | 锌粒与稀硫酸 | 双氧水与二氧化锰 | 氯酸钾与二氧化锰 |
Y | 氢氧化钠 | 氢氧化钠 | 氢氧化钠 | 氢氧化钠 |
Z | CO2 | H2 | O2 | O2 |
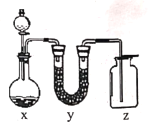
A. AB. BC. CD. D
【题目】实验室有一包固体药品,可能含有BaSO4、Na2CO3、CuSO4、NaCl、CaCl2、NaOH中的一种或几种,为确定其成分,某班同学在老师的指导下进行探究。
(一)定性探究:
Ⅰ.称取少量样品,加入足量水中充分溶解,过滤后得到白色沉淀和无色滤液。由实验现象可知,原固体中一定不含____;
Ⅱ.取Ⅰ中得到的滤液少量,设计实验继续探究原固体的成分,请帮他们完成实验报告并回答问题。
操作 | 现象 | 结论 |
向滤液中加入足量氯化钙溶液 | 产生白色沉淀 | 原固体中一定含有____ |
取上层清液,滴加____ | ____ | 原固体中不含NaOH |
其中,步骤加入足量氯化钙溶液的目的除了检验一定含有的物质外,还能起到的作用是____;
Ⅲ.再取Ⅰ中得到的滤液少量,进行如下操作:
![]()
同学们认为:原固体中一定含有NaCl。但是老师指出这个结论不正确,其理由是___(填序号)
A.滤液中含有Na2CO3,也能和AgNO3反应生成沉淀
B.滤液中的NaCl可能是由原固体中的Na2CO3和CaCl2反应生成
(二)定量探究:
在老师的指导下同学们又精确称量了10g原固体,进行如下实验:
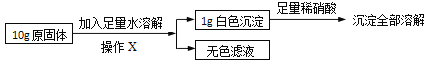
同学们认为,根据“沉淀全部溶解”的现象可确定白色沉淀的成分是____,则原固体中一定不含____;其中,操作X的名称是____,无色滤液中一定含有的阳离子是____。
试根据生成沉淀的质量计算原固体中氯化钙的质量分数,写出计算过程_____。