题目内容
【题目】等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如图所示,下列叙述正确的是( )
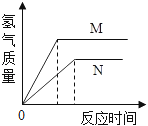
A.M、N两种金属中较活泼的是N
B.生成H2的质量M<N
C.相对原子质量较大的是N
D.产生H2的速率N>M
【答案】C
【解析】
试题分析:根据金属活动性顺序的意义进行分析,在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.
解:A、据图可以看出,单位时间内M产生的氢气比N多,故M比N 活泼,故A错误;
B、据图可以看出,最终产生的氢气的质量M比N多,故B错误;
C、等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应,相对原子质量越大,产生的氢气越少,故C正确;
D、据图可以看出,单位时间内M产生的氢气比N多,所以M的速率比N大,故D错误.
故选C.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目