题目内容
【题目】原水(未经处理的水)中含有泥沙悬浮物和细菌等杂质,可用次氯酸杀死细菌。氯气溶解于水时,可生成盐酸和次氯酸。某水厂生产自来水的净化步骤如下:
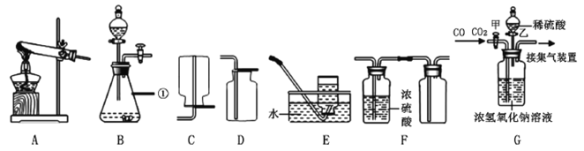
![]()
(1)可以除去大颗粒悬浮物杂质的步骤是___________(填标号)。
(2)A步骤中加明矾的作用为__________________。
(3)该厂生产的自来水是________。(填“纯净物”或“混合物”)
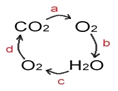
(4)能消毒杀菌的步骤为___________________(填标号)。 自来水消毒过程中常会发生如下化学反应,其反应的微观过程可用下图表示:

①图乙所示反应的基本反应类型为________反应;
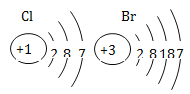
②上述物质中,属于单质的有________ (填化学式); ③D物质中氯元素的化合价为________;
④以甲图为例分析,你能总结出一条结论是_________________________________。
【答案】 BC 絮凝剂 混合物 D 分解 Cl2 ,O2 +1 在化学反应中,分子可以分为原子,原子又可以结合成新的分子
【解析】本题考查了自来水的生产过程与净化方法,单质和化合物的判别,微粒观点及模型图的应用,化学式的书写,有关元素化合价的计算及反应类型的判定。
(1)在净化水时,通过沉淀、过滤可以除去大颗粒悬浮物杂质,故选BC;
(2)明矾在溶于水时能形成胶状物,吸附杂质,形成较大颗粒而加快沉降,加明矾的作用为絮凝剂;
(3)该厂生产的自来水中含有可溶性物质,属于混合物;
(4)加入氯气,氯气与水作用而杀死水中病毒,起到消毒杀菌的作用,能消毒杀菌的步骤为D;①由图乙可知反应物是一种,生成物是两种,属于分解反应;②氯气、氧气都是由同种元素组成的纯净物,属于单质,化学式分别为:Cl2 , O2; ③D是次氯酸,其中氢元素是+1价,氧元素是﹣2价,根据化合价的代数和为零,可以求出氯元素的化合价是+1价;以甲图为例,可得出:在化学反应中,分子可以分为原子,原子又可以结合成新的分子。

【题目】下表是NaCl和KNO3在不同温度时的溶解度,回答问题。
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 | |
(1)两种物质中,溶解度受温度影响变化较大的是_________。
(2)60℃时,按图示操作:
![]()
A中溶质是_____(填“饱和”或“不饱和”)溶液,C中溶液的总质量是______g。
(3)50℃时,将两种物质的饱和溶液各100g,分别加热蒸发10g水后,再恢复到50℃,剩余溶液的质量:NaCl溶液_____(填“大于”“等于”或“小于”) KNO3溶液。
【题目】某化学兴趣小组的同学在探究氢氧化钠的性质时,将二氧化碳通入盛有氢氧化钠溶液的试管中,没有观察到现象,小组同学对氢氧化钠和二氧化碳是否发生反应产生了兴趣,他们又做了如图所示两组实验.
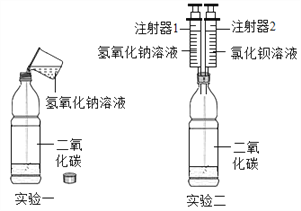
(1)实验一:将氢氧化钠溶液加入装有二氧化碳的软塑料瓶中,旋紧瓶盖振荡,观察到软塑料瓶变瘪,小组同学认为氢氧化钠和二氧化碳发生了反应,反应化学方程式为________.其中一位同学提出了质疑,认为根据上述实验现象不足以证明二者发生了化学反应,其理由是___________,得到了小组其他同学的认同.
(2)实验二:小组同学将实验一做了改进,将注射器1中的氢氧化钠溶液注入拧紧瓶盖的软塑料瓶中振荡,观察到软塑料瓶变瘪,再将注射器2中的氯化钡溶液注入瓶中,观察到_____________,证明氢氧化钠与二氧化碳发生了反应.
(3)实验结束后,兴趣小组的同学又提出了新问题:实验二软塑料瓶内溶液中溶质是什么?
【查阅资料】a.氯化钡溶液呈中性;b.碳酸钡不溶于水.
【设计实验】小组同学继续进行实验,请你补充完整.
实验步骤 | 实验现象 | 实验结论及化学方程式 |
①将软塑料瓶中的物质过滤,取少量滤液于试管中,向其中滴加酚酞溶液 | 溶液不变色 | 软塑料瓶内溶液中的溶质是_______ 步骤②反应的化学方程式______ |
②向步骤①的试管中滴加稀硫酸 | 产生白色沉淀 |
【实验反思】在分析化学反应后所得物质成分时,除考虑生成物外,还需考虑的是________.