题目内容
用质量相等的锌粉和铁粉,分别与溶质质量分数相同、等质量的稀盐酸充分反应.产生氢气的质量和反应所用时间的关系如图所示.则下列说法不正确的是( )
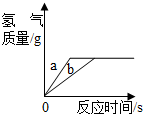
| A.曲线a、b分别表示锌、铁的反应情况 |
| B.盐酸均反应完,锌、铁均有剩余 |
| C.盐酸均反应完,锌恰好完全反应,铁有剩余 |
| D.锌、铁都反应完,盐酸有剩余 |

根据化学方程式:Zn+2HCl=ZnCl2+H2↑;Fe+2HCl═FeCl2+H2↑进行计算:
A、因为锌的活动性比铁的活动性强,等质量的金属,锌反应的时间短,故A说法正确;
B、盐酸均反应完,因为氯化氢相等,锌、铁均有剩余;所以生成的氢气相等,故B说法正确;
C、如果盐酸均反应完,锌恰好完全反应,铁有剩余,故C说法正确;
D、如果锌、铁都反应完,而盐酸有剩余,则产生的氢气一定不等,D说法不正确.
故选D
A、因为锌的活动性比铁的活动性强,等质量的金属,锌反应的时间短,故A说法正确;
B、盐酸均反应完,因为氯化氢相等,锌、铁均有剩余;所以生成的氢气相等,故B说法正确;
C、如果盐酸均反应完,锌恰好完全反应,铁有剩余,故C说法正确;
D、如果锌、铁都反应完,而盐酸有剩余,则产生的氢气一定不等,D说法不正确.
故选D

练习册系列答案
相关题目
 (2011?德州)用质量相等的锌粉和铁粉,分别与溶质质量分数相同且等质量的稀盐酸充分发生反应,产生氢气的质量与时间的关系如右图所示.
(2011?德州)用质量相等的锌粉和铁粉,分别与溶质质量分数相同且等质量的稀盐酸充分发生反应,产生氢气的质量与时间的关系如右图所示. 15、用质量相等的锌粉和铁粉,分别与溶质质量分数相同、等质量的稀盐酸充分反应.产生氢气的质量和反应所用时间的关系如图所示.则下列说法不正确的是( )
15、用质量相等的锌粉和铁粉,分别与溶质质量分数相同、等质量的稀盐酸充分反应.产生氢气的质量和反应所用时间的关系如图所示.则下列说法不正确的是( ) 用质量相等的锌粉和铁粉分别与溶质质量分数相同、等质量的稀盐酸充分反应,产生氢气质量与所用时间的关系如图所示.则下列说法中与曲线相符合的是( )
用质量相等的锌粉和铁粉分别与溶质质量分数相同、等质量的稀盐酸充分反应,产生氢气质量与所用时间的关系如图所示.则下列说法中与曲线相符合的是( ) 用质量相等的锌粉和铁粉,分别与溶质质量分数相同且等质量的稀盐酸充分发生反应,产生氢气的质量与时间的关系如图所示.对于a曲线表示的反应,有剩余的物质是( )
用质量相等的锌粉和铁粉,分别与溶质质量分数相同且等质量的稀盐酸充分发生反应,产生氢气的质量与时间的关系如图所示.对于a曲线表示的反应,有剩余的物质是( )