题目内容
某有机物完全燃烧生成CO2和水时,消耗化合物和氧分子的个数比为1:3,则该有机物是( )A.CH4
B.C2H6
C.C2H5OH
D.CH3OH
【答案】分析:可先设出有机物的化学式,利用有机物和O2参加反应的分子个数之比写出化学反应,再根据质量守恒定律利用原子个数在反应前后相等来推断有机物的化学式.
解答:解:由题意可知.有机物完全燃烧生成CO2和H2O,设有机物的化学式为CxHyOz,则根据有机物和O2参加反应的分子个数之比为1:3,得化学方程式为CxHyOz+3O2 xCO2+
xCO2+ H2O
H2O
由氧原子守恒得2x+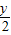 =3×2+z,
=3×2+z,
A、2×1+ ≠3×2+0,则氧原子不守恒,故A错误;
≠3×2+0,则氧原子不守恒,故A错误;
B、2×2+ ≠3×2+0,则氧原子不守恒,故B错误;
≠3×2+0,则氧原子不守恒,故B错误;
C、2×2+ =3×2+1,则氧原子守恒,故C正确;
=3×2+1,则氧原子守恒,故C正确;
D、2×1+ ≠3×2+1,氧原子不守恒,故D错误.
≠3×2+1,氧原子不守恒,故D错误.
故选C.
点评:本题考查了根据反应物的微粒个数比确定化学式,利用化学反应中氧原子守恒来解答是常用的方法,也可利用代入法一一验证有机物和氧气参加反应的分子个数之比是否符合1:3.
解答:解:由题意可知.有机物完全燃烧生成CO2和H2O,设有机物的化学式为CxHyOz,则根据有机物和O2参加反应的分子个数之比为1:3,得化学方程式为CxHyOz+3O2
 xCO2+
xCO2+ H2O
H2O由氧原子守恒得2x+
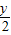 =3×2+z,
=3×2+z,A、2×1+
 ≠3×2+0,则氧原子不守恒,故A错误;
≠3×2+0,则氧原子不守恒,故A错误;B、2×2+
 ≠3×2+0,则氧原子不守恒,故B错误;
≠3×2+0,则氧原子不守恒,故B错误;C、2×2+
 =3×2+1,则氧原子守恒,故C正确;
=3×2+1,则氧原子守恒,故C正确;D、2×1+
 ≠3×2+1,氧原子不守恒,故D错误.
≠3×2+1,氧原子不守恒,故D错误.故选C.
点评:本题考查了根据反应物的微粒个数比确定化学式,利用化学反应中氧原子守恒来解答是常用的方法,也可利用代入法一一验证有机物和氧气参加反应的分子个数之比是否符合1:3.

练习册系列答案
相关题目
某有机物完全燃烧生成CO2和H2O,已知该有机物和O2参加反应的分子个数之比为1:3,则该有机物的化学式可能是( )
| A、C2H6O | B、CH4 | C、C2H2 | D、CH2O |