题目内容
【题目】同学要在实验室配制15%的氯化钠溶液50g.该同学按下图所示步骤依次操作:请回答下列问题:
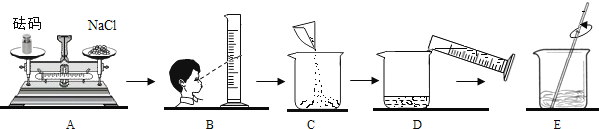
(1)若用氯化钠固体配制,需称取氯化钠 g.
(2)其中操作错误的步骤是 (填字母);
(3)E中玻璃棒的作用是
(4)若上图A中砝码的质量为5g,游码为2.5g,则小明称得的氯化钠质量实际为 g
(5)若上图中A步骤操作正确,所称氯化钠质量准确,而操作B会导致所得溶液溶质质量分数 15%(填“大于”“小于”或“等于”)
(6)若用30%的氯化钠溶液配制,需30%的氯化钠溶液 g;蒸馏水 g.
【答案】(1)7.5;
(2)AB;
(3)搅拌,加速溶解;
(4)2.5;
(5)小于;
(6)25;25.
【解析】
试题分析:(1)根据溶质质量分数公式可以计算出所需氯化钠的质量;
(2)根据用托盘天平时应左物右码,量筒读数时应使视线与凹液面的最低处保持水平解答;
(3)根据玻璃棒的用途来分析;
(4)根据根据天平的使用方法是左物右码,左盘的质量等于右盘的质量加游码的质量,即药品质量=砝码质量+游码质量,如果位置放反,根据左盘的质量=右盘的质量+游码的质量,列等式进行计算;
(5)根据量筒的正确读法来分析;
(6)根据溶液稀释过程中,溶质的质量不变来分析.
解:(1)需氯化钠的质量为50g×15%=7.5g;故填:7.5;
(2)使用托盘天平时应左物右码,量筒读数时应使视线与凹液面的最低处保持水平,故填:AB;
(3)在此实验中玻璃棒的作用为搅拌,其目的为加速溶解;故填:搅拌,加速溶解;
(4)托盘天平中左盘的质量=右盘的质量+游码的质量,因为称量时药品与砝码放反了,所以药品的实际质量为5g﹣2.5g=2.5g.故填:2.5;
(5)某同学在量取所需的水时,该同学仰视量筒内液面的最低处时进行读数,会造成读数比实际液体体积小,会造成实际量取的水的体积偏大,则所得溶液溶质质量分数偏小;故填:小于;
(6)溶液稀释过程中,溶质的质量不变,设需30%的氯化钠溶液的质量为x,则
30%x=50g×15%
x=25g
加水的质量为50g﹣25g=25g
故填:25;25.

【题目】某学习小组拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2).查阅资料可知Mg、Mg3N2能发生如下反应:
①2Mg+O2![]() 2MgO;
2MgO;
②3Mg+N2![]() Mg3N2;
Mg3N2;
③2Mg+CO2![]() 2MgO+C
2MgO+C
④Mg+H2O![]() MgO+H2↑
MgO+H2↑
⑤Mg3N2+6H2O![]() 3Mg(OH)2↓+2NH3↑
3Mg(OH)2↓+2NH3↑
实验中所用的装置和药品如图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连).回答下列问题:
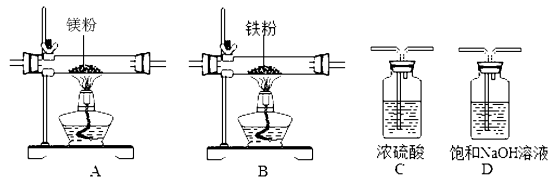
(1)连接并检查实验装置的气密性,实验开始时,将空气通入实验装置,则气流流经装置的顺序是_____→ _____→B→_____(填装置序号).D装置中发生反应的化学方程式为_____.
(2)通气后,应向点燃_____(填“A”或“B”)装置的酒精灯,如果同时点燃A、B装置的酒精灯,对实验结果有何影响?_____.
(3)设计一个实验,验证产物是氮化镁:
实验操作和实验现象 | 实验结论 |
______________ | 产物是氮化镁 |
(4)思维拓展:空气中N2的含量远大于O2的含量,而镁条在空气正燃烧生成的MgO的质量却远大于Mg3N2的质量,请给出合理的解释______________.