题目内容
【题目】黄铜是铜锌合金,取20.0g某黄铜投入100g某浓度的稀硫酸中,完全反应后生成的溶液和残余固体总质量为119.8g。请计算:
(1)产生氢气的质量为________g。
(2)这种黄铜中锌的质量分数为多少________?
(3)求最后所得溶液中溶质的质量分数________。
【答案】0.2 67.5% 15.1%
【解析】
(1)根据质量守恒定律可以知道,用黄铜和稀硫酸的质量和减去剩余溶液和残余固体总质量就是生成气体的质量。
(2)由气体的质量根据锌与硫酸反应的化学方程式可以计算出黄铜中锌的质量,进而求得铜的质量分数。
(3)由气体的质量根据锌与硫酸反应的化学方程式可以计算出生成硫酸锌的质量,进而计算出本题答案。
解:(1)根据质量守恒定律可以知道,产生氢气的质量为:20.0g+100g-119.8g=0.2g
(2)设参加反应的锌的质量为x,生成的硫酸锌的质量为y。
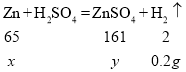
![]()
x=6.5g,y=16.1g
黄铜中铜的质量分数为:![]()
剩余溶液中硫酸锌的质量分数为:![]()
答:(1)产生氢气的质量为0.2g.
(2)黄铜中铜的质量分数为67.5%;
(3)剩余溶液中硫酸锌的质量分数为15.1%.

 阅读快车系列答案
阅读快车系列答案【题目】物质构成的奥秘,能帮助我们更好的认识物质变化的本质.
(1)根据原子结构示意图分析,不能确定的是________ (填字母)
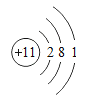
A 元素种类 B 原子的质子数 C 相对原子质量 D 元素的化学性质
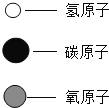
(2)A、B、C、D表示四种物质,其微观示意图见下表.A、B在高温条件下反应能生成C和D。
物质 | A | B | C | D |
|
微观示意图 |
|
|
|
|
①四种物质中属于化合物的是________ (填字母,下同).
②该反应的化学方程式为________
③根据以上微观示意得出的下列说法中,正确的是 _______ .
A 分子、原子都可以直接构成物质 B 参加反应的B与生成物C的质量比为3:7
C D是一种理想的清洁燃料 D C物质有毒,排放到空气中会造成空气污染