题目内容
【题目】粗盐中含有泥沙等难溶性杂质和氯化镁、氯化钙等可溶性杂质,某学习小组做粗盐的提纯实验.
【提出问题】如何才能将粗盐中的杂质除去,获得精盐?
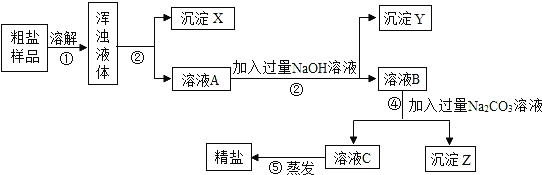
【实验方案】该小组按以下流程进行实验.
【问题讨论】
(1)实验步骤②③④都需要进行 操作,该操作中玻璃棒的作用是 .
(2)沉淀X是 ,沉淀Y是 .
(3)有同学认为该实验方案不完善,请你说明原因并补充完善: .
(4)将实验所得的精盐在烧杯中配制成100g 8%的氯化钠溶液.经检测,所配溶液溶质质量分数偏小,其可能原因有 (填序号).
①精盐称量时,仅在左盘垫上了称量纸,而右盘没有垫上称量纸;
②溶解时所用烧杯不干燥;
③所得精盐未完全干燥.
(5)工业上用电解饱和食盐水的方法可制取氢氧化钠,同时还生成两种气体单质.写出此反应的化学方程式 .
【答案】(1)过滤;引流;(2)泥沙; Mg(OH)2;
(3)原因是除MgCl2、CaCl2时引入新杂质NaOH、Na2CO3;应在溶液C中加入足量的稀盐酸后再进行蒸发操作.(或其它合理答案)
(4)①②③;
(5)2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑.
2NaOH+Cl2↑+H2↑.
【解析】(1)该操作都是将液体与难溶性固体分离的方法,是过滤,在过滤操作中玻璃棒的作用是引流;
(2)粗盐中含有泥沙,故X是泥沙,溶液A中含有氯化钠、氯化镁和氯化钙,加入氢氧化钠后,氢氧化钠与氯化镁反应生成氢氧化镁白色沉淀,故Y是氢氧化镁;
(3)做出这种评价的依据是:在除去MgCl2和CaCl2的同时,又引入了新的杂质NaOH和Na2CO3.为了完善原实验方案除去杂质,做法是:向溶液C中加入过量稀盐酸.
(4)①导致称取的氯化钠偏少,造成溶质的质量分数偏小;
②导致溶液中的溶剂偏多,造成溶质的质量分数偏小;
③精盐未干燥造成氯化钠偏少,造成溶质的质量分数偏小;
(5)电解饱和食盐水可制取氢氧化钠、氢气和氯气,该反应的化学方程式为2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑.
2NaOH+Cl2↑+H2↑.

【题目】从分子的角度分析并解释下列事实,不正确的是( )
选项 | 事实 | 解释 |
A | 碘酒是混合物 | 由不同种分子构成 |
B | 端午时节粽飘香 | 分子在不断运动着 |
C | 气体受热膨胀 | 温度升高,分子自身体积增大 |
D | 固体碘受热升华 | 碘分子间的间隔变大 |