题目内容
有表面被氧化的镁条4.8g,跟81.9g稀硫酸恰好完全反应,生成氢气0.3g,计算:(1)该镁条中含镁元素的质量。
(2)跟稀硫酸完全反应后,生成物溶液中溶质的质量分数。
答案:
解析:
提示:
解析:
| 解:(1)设原镁条中含镁单质的质量为x,Mg与H2SO4反应后生成MgSO4的质量为y
Mg+H2SO4 24 120 2 x y 0.3g
含MgO4.8g-3.6g=1.2g 原镁条中含镁元素3.6g+1.2g´ (2)设MgO与H2SO4反应后生成MgSO4的质量为z MgO+H2SO4 40 120 1.2g z
所得MgSO4溶液中溶质的质量分数为:
|
提示:

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
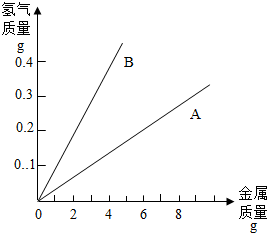


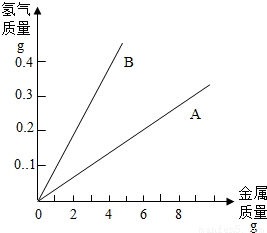
 Si+2R↑,则R的化学式为 ,反应后硅元素的化合价 (填写“升高”或“降低”).
Si+2R↑,则R的化学式为 ,反应后硅元素的化合价 (填写“升高”或“降低”).