题目内容
【题目】已知室温时氯化钠的溶解度为36g,将氢氧化钠和氯化钠的混合物16.3g,放入83.7g水中使其完全溶解,再加入100g溶质质量分数为7.3%的稀盐酸,恰好完全反应.试计算: 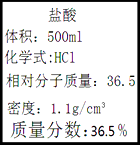
(1)实验室有一瓶标签如图所示的浓盐酸,要配制100g7.3%的盐酸,需要用该盐酸ML
(2)原混合物中氢氧化钠的质量.
(3)反应后所得溶液中溶质的质量分数.
(4)将反应后的溶液冷却到室温,若要配制室温时的饱和溶液,还需向其中加入多少克氯化钠固体?
【答案】
(1)18.2
(2)解:设氢氧化钠质量为x,生成氯化钠质量为y,
稀盐酸中氯化氢质量为:100g×7.3%=7.3g,
NaOH+HCl═NaCl+H2O,
40 36.5 58.5
x 7.3g y
![]() ,
,
x=8g,y=11.7g,
答:原混合物中氢氧化钠的质量是8g.
(3)解:反应后所得溶液中溶质的质量分数为: ![]() ×100%=10%,
×100%=10%,
答:反应后所得溶液中溶质的质量分数为10%
(4)解:设需要加入氯化钠的质量为z,
根据题意有:(100g+36g):36g=(200g+z):(16.3g﹣8g+11.7g+z),
z=44.8g,
答:还需向其中加入44.8g氯化钠
【解析】解:(1)因为溶液稀释前后,溶质质量不变,要配制100g7.3%的盐酸,需要用该盐酸的质量为:100g×7.3%÷36.5%=20g,则需要浓盐酸体积为:
20g÷1.1g/mL=18.2mL,
故填:18.2.
【考点精析】本题主要考查了根据化学反应方程式的计算的相关知识点,需要掌握各物质间质量比=系数×相对分子质量之比才能正确解答此题.

练习册系列答案
相关题目

