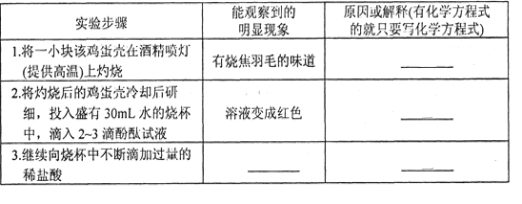
题目内容
【题目】(7分)为测定石灰石样品中碳酸钙的含量,小明取25 g石灰石样品与-定质量的7.3%的稀盐酸恰好完全反应,将反应所得混合物蒸干得到固体27.2g(不含结晶水,假设样品中的杂质既不与稀盐酸反应也不溶于水)。试计算:
(1)参加反应的盐酸的质量。
(2)石灰石样品中碳酸钙的含量。
(3)上述反应所得滤液中溶质的质量分数。
【答案】(1)200g (2)80% (3)10.5%
【解析】
试题分析:解:(1)反应前后固体质量之差为27.2g-25g=2.2g
设参加反应的碳酸钙的质量为X,参加反应的盐酸的溶质的质量为Y,反应生成氯化钙的质量为Z,生成二氧化碳的质量为M,
CaCO3+2HCl═CaCl2+H2O+CO2↑ 反应前后固体的质量差
100 73 111 44 111-100=11
X Y Z M 2.2g
![]()
解之得:X=20g,Y=14.6g,Z=22.2g,M=8.8g
∴参加反应的盐酸的质量为![]() =200g
=200g
答:反应的盐酸的质量为200g
(2)石灰石样品中碳酸钙的含量为:
![]() ×100%=80%
×100%=80%
(3)反应后所得溶液为氯化钙溶液,溶液质量=20+200-8.8=211.2g
所得溶液溶质的质量分数为![]() ×100%≈10.5%
×100%≈10.5%
答:所得溶液溶质的质量分数为10.5%

练习册系列答案
相关题目