题目内容
为了探究铁和铜的金属活动性顺序,请根据实验室现有的仪器和药品条件(如下所列),设计实验方案.
【实验仪器】试管、胶头滴管、镊子.
【实验药品】铁钉、铜片、稀硫酸、硫酸锌溶液、硫酸亚铁溶液,硫酸铜溶液.
请你利用现有条件,设计两种方案进行探究(只需要写出每个方案所需仪器、药品).并写出其中涉及的一个化学方程式.
【实验仪器】试管、胶头滴管、镊子.
【实验药品】铁钉、铜片、稀硫酸、硫酸锌溶液、硫酸亚铁溶液,硫酸铜溶液.
请你利用现有条件,设计两种方案进行探究(只需要写出每个方案所需仪器、药品).并写出其中涉及的一个化学方程式.
分析:根据金属活动性顺序可知铁>氢>铜,要想通过实验证明铁的活动性比铜强,可以把两种金属分别放入酸中看是否反应,也可以把一种金属放入另一种金属的盐溶液中看是否反应.依据所提供的试剂和仪器,尽量选择简便易行,现象明显的实验方案.
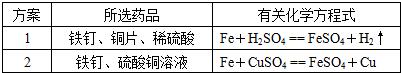
解答:解:由金属活动性顺序表的应用可知,铁能和酸反应放出氢气,铜不能,所以可以把两种金属分别放入稀硫酸酸中来证明它们的活动性;也可以通过金属活动性顺序的规律,前面的金属能把后面的金属从它的盐溶液中置换出来,所以可选用铁和硫酸铜溶液反应来证明.用到的仪器主要有试管及镊子.所以设计方案如下:
故答为:见上表.
| 方案 | 所选药品、仪器 | 有关化学方程式 |
| 1 | 铁钉、铜片、稀硫酸,试管、镊子. | Fe+H2SO4═FeSO4+H2↑ |
| 2 | 铁钉、硫酸铜溶液,试管、镊子. | Fe+CuSO4═FeSO4+Cu |
点评:氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来,这是解决这类问题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目