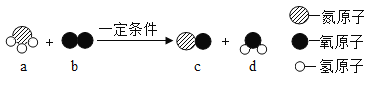
题目内容
【题目】(1)当氧化钠( Na2O)和过氧化钠( Na2O2 )质量相等时,其中氧元素的质量比为_____。
(2)已知某化学反应2A+B=3C,若10gA 与6gB充分反应,则生成C的质量可能是_____;(填序号)
①5g ②6g ③8g ④10g ⑤16g ⑥l8g
(3)一定质量的某化合物与12.8g氧气在密闭容器中恰好完全反应,测得生成8.8g二氧化碳、5.6g 一氧化碳和7.2g 水,且该化合物的相对分子质量为88,求该化合物的化学式_____; (提示:化学式请按照CHO的顺序书写)
(4)现有一定质量的氯酸钾和二氧化锰的固体混合物,加热至固体质量不再变化为止,所得固体质量与原来混合物中的氯酸钾质量相同,求所得固体中二氧化锰的质量分数为_____。
【答案】39:62 ③④⑤ ![]() 39.2%
39.2%
【解析】
(1)由于氧化钠(Na2O)和过氧化钠(Na2O2)质量相等,可设均为m。
则氧化钠中含有氧元素的质量为:
m×![]() ×100%=
×100%=![]() ×100%×m;
×100%×m;
过氧化钠中含有氧元素的质量为:m×![]() ×100%=
×100%=![]() ×100%×m;
×100%×m;
所以氧化钠与过氧化钠中,氧元素的质量比为:
(![]() ×100%×m):(
×100%×m):(![]() ×100%×m)=39:62;
×100%×m)=39:62;
(2)根据质量守恒定律,若10gA和6gB恰好反应,生成C的质量就是16g,若不恰好反应,则生成C的质量就是小于16g,但生成C的质量大于其中质量最小的反应物的质量,所以生成C的质量可能是③④⑤;
(3)二氧化碳中碳元素的质量为:8.8g×![]() ×100%=2.4g,氧元素的质量为:8.8g-2.4g=6.4g;
×100%=2.4g,氧元素的质量为:8.8g-2.4g=6.4g;
水中氢元素的质量为:7.2g×![]() ×100%=0.8g,氧元素的质量为:7.2g-0.8g=6.4g;
×100%=0.8g,氧元素的质量为:7.2g-0.8g=6.4g;
一氧化碳中碳元素的质量为:5.6g×![]() ×100%=2.4g,氧元素的质量为3.2g;
×100%=2.4g,氧元素的质量为3.2g;
依据质量守恒定律可知,某化合物中碳元素的质量为:2.4g+2.4g=4.8g,氢元素的质量为:0.8g,氧元素的质量为:6.4g+6.4g+3.2g-12.8g=3.2g,
碳、氢、氧原子个数比是:![]() :
:![]() :
:![]() =0.4:0.8:0.2=2:4:1;
=0.4:0.8:0.2=2:4:1;
且该化合物的相对分子质量为88,所以该化合物的化学式为:C4H8O2;
(4)由于所得固体质量与原来混合物中的氯酸钾质量相同,又因为氯酸钾中的氧元素全部转化成了氧气,所以混合物中的二氧化锰的质量分数与氯酸钾中氧元素的质量分数相等。
所以所得固体中二氧化锰的质量分数为:![]() ×100%≈39.2%。
×100%≈39.2%。
故答案为:
(1)39:62;
(2)③④⑤;
(3)C4H8O2;
(4)39.2%。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案【题目】小华同学围绕“铁在氧气中燃烧”的实验展开以下探究活动。
(1)写出铁丝在氧气中燃烧的文字或符号表达式_____,该反应属于_____(填基本反应类型)
①实验前将铁丝绕成螺旋状的目的是_____
②确保实验成功还要做到_____(写一点);
(2)(实验探究)探究铁丝在氧气中燃烧时“火星四射”的现象与其含碳量的关系
实验 | 现象 | 解释与结论 |
实验1:取直径0.20mm、含碳0.1%的铁丝在氧气中燃烧 | 零星的火星四射 | 0.20mm的铁丝,在氧气中燃烧“火星四射”与其含碳量的关系为_____ |
实验2:取直径0.20mm、含碳0.32%的铁丝,在氧气中燃烧 | 较明显的火星四射 | |
实验3:取_____的铁丝,在氧气中燃烧 | _____ |
(拓展延伸)他认为铁丝燃烧的现象还与氧气的浓度有关,所以想收集不同浓度的氧气进行相关实验,若用排水法收集一瓶体积分数为90%的氧气,因为氧气约占空气体积的_____,所以应预先向容积为400ml的集气瓶中加入水的体积为_____ml。