题目内容
加热氧化铜与木炭的混合物35g,经过一段时间后,冷却,称得固体剩余物的质量为21.2g.求反应中有多少克氧化铜被还原了?(本题仅限发生生成二氧化碳)
【答案】分析:氧化铜和木炭粉在高温的条件下生成铜和二氧化碳气体,由于气体逸出,所以反应后固体质量会减少,根据质量守恒定律,固体质量的减少量即为氧元素的质量,然后根据反应方程式由氧元素的质量求出被还原的氧化铜的质量.
解答:解:根据质量守恒定律可知,减少的质量为氧元素:氧元素的质量是35g-21.2g=13.8g
设被还原的氧化铜的质量为x
2CuO+C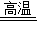 2Cu+CO2↑△m
2Cu+CO2↑△m
160 44 160-44=116
x 13.8g
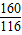 =
=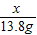
x≈19g
答:被还原的氧化铜的质量为19g.
点评:此题考查的是有关化学方程式的计算,依据质量守恒定律得出反应中产生气体的质量是解答此题的关键.
解答:解:根据质量守恒定律可知,减少的质量为氧元素:氧元素的质量是35g-21.2g=13.8g
设被还原的氧化铜的质量为x
2CuO+C
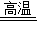 2Cu+CO2↑△m
2Cu+CO2↑△m160 44 160-44=116
x 13.8g
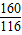 =
=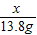
x≈19g
答:被还原的氧化铜的质量为19g.
点评:此题考查的是有关化学方程式的计算,依据质量守恒定律得出反应中产生气体的质量是解答此题的关键.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||