题目内容
下列说法正确的是( )
分析:A、原子由原子核和核外电子组成;原子核由质子和中子组成,质子带正电而中子不带电,而核外电子带负电,故如果质子数与电子数相等时,物体呈电中性,即不带电;
B、根据元素是具有相同核电荷数(即核内质子数)的一类原子的总称,决定元素种类的是核电荷数(即核内质子数),据此进行分析;
C、气体溶解度的影响因素主要是指温度和压强:气体的溶解度随温度的升高而减小(随温度的降低而增大),随压强的增大而增大(随压强的减小而减小);
D、分离两种可溶性且溶解度随温度变化差别大的固体时,采用降温结晶的方法.
B、根据元素是具有相同核电荷数(即核内质子数)的一类原子的总称,决定元素种类的是核电荷数(即核内质子数),据此进行分析;
C、气体溶解度的影响因素主要是指温度和压强:气体的溶解度随温度的升高而减小(随温度的降低而增大),随压强的增大而增大(随压强的减小而减小);
D、分离两种可溶性且溶解度随温度变化差别大的固体时,采用降温结晶的方法.
解答:解:A、原子内部正电荷数与负电荷数相等,所以原子一般不显示电性.故A说法错误;
B、不同元素最本质的区别是核电荷数不同.故B说法错误;
C、升高温度时,气体的溶解度是减小而不是增大.故C说法错误;
D、NaCl的溶解度受温度的影响变化不大,KNO3的溶解度随温度的升高而增大.所以利用降温结晶法可以将它们分离.故D说法正确.
故选D.
B、不同元素最本质的区别是核电荷数不同.故B说法错误;
C、升高温度时,气体的溶解度是减小而不是增大.故C说法错误;
D、NaCl的溶解度受温度的影响变化不大,KNO3的溶解度随温度的升高而增大.所以利用降温结晶法可以将它们分离.故D说法正确.
故选D.
点评:此题易错的是C选项.注意:气体溶解度的影响因素主要是指温度和压强.具体的变化规律是:气体的溶解度随温度的升高而减小(随温度的降低而增大),随压强的增大而增大(随压强的减小而减小).可以简记为4个字,即“温反压正”;其含义是气体的溶解度与温度成反比关系,与压强成正比关系.

练习册系列答案
相关题目
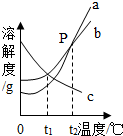 图是a.b.c三种物质的溶解度曲线,下列说法正确的是( )
图是a.b.c三种物质的溶解度曲线,下列说法正确的是( )| A、a的溶解度大于b的溶解度 | B、c一定是熟石灰的溶解度曲线 | C、P点表示在t2℃时,a、b两种物质的饱和溶液中溶质的质量分数相同 | D、三种物质的饱和溶液分别从t2℃降温到t1℃,a、b析出的晶体质量相等 |
 18、二百多年前,法国化学家拉瓦锡用定量的方法研究空气成分,其中一项实验是加热红色氧化汞粉末得到汞和氧气,该反应示意图如下:下列说法正确的是( )
18、二百多年前,法国化学家拉瓦锡用定量的方法研究空气成分,其中一项实验是加热红色氧化汞粉末得到汞和氧气,该反应示意图如下:下列说法正确的是( )