题目内容
【题目】锶元素的粒子结构示意图和在元素周期表中显示的信息如图所示:
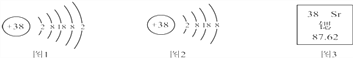
(1)锶属于_____________元素(填“金属”或“非金属”)。
(2)锶元素的原子序数为_____________,相对原子质量为_______________。
(3)氧化锶的化学式是___________,氧化锶与水能发生化合反应生成氢氧化锶并放出大量热,请你写出反应的化学方程式______________________。
(4)图2所表示的粒子的化学符号是_______________。
【答案】金属3887.62SrOSrO+H2O=Sr(OH) 2Sr2+
【解析】(1)由锶元素的原子结构示意图,可知其最外层电子数,可推测元素种类;也可根据汉语名称,推测元素种类;
(2)由锶元素的粒子结构示意图和“原子序数=核内质子数=核外电子数=核电荷数”可知,锶元素的原子序数;根据在元素周期表中显示的信息,可知相对原子质量;
(3)根据元素周期表查出锶元素的元素符号,根据反应物与生成物写出反应的化学方程式;
(4)图2所表示的粒子为锶原子失去最外层电子所得的结构,根据失去的电子数,可知带电荷数;根据在元素周期表中显示的信息,可知其元素符号,故可书写粒子符号。
解:(1)由锶元素的粒子结构示意图,可知其最外层电子数为2,符合金属元素的最外层电子数一般小于4的特点,可推测元素种类为金属元素;也可根据汉语名称“锶”,带“钅”,故推测元素种类为金属元素;
(2)由锶元素的粒子结构示意图和规律“原子序数=核内质子数=核外电子数=核电荷数”可知,则锶元素的原子序数为38;根据在元素周期表中显示的信息,可知相对原子质量87.62;
(3)由元素周期表查出锶元素的元素符号为Sr,反应的化学方程式为:SrO+H2O=Sr(OH)2;
(4)图2所表示的粒子为锶原子失去最外层电子所得的结构,根据失去的电子数为2,可知带2个正电荷;根据在元素周期表中显示的信息,可知其元素符号为Sr,故可书写粒子符号为Sr2+。
故答为:(1)金属;(2)38;87.62;(3)Sr,SrO+H2O=Sr(OH)2;(4)Sr2+

【题目】一包干燥的红色粉末是Cu、Fe2O3的混合物,同学们为确定红色粉末的组成比例,称取该粉末5.0g装硬质玻璃管中,按右下图在通风橱中进行实验。开始时缓缓通入CO气体,过一段时间后再加热使其充分反应。待反应完全后,停止加热,继续通CO气体直至玻璃管冷却。
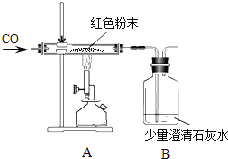
在装置A中先通CO气体的目的是_____________
②反应前后称量相关装置和物质的总质量,其数据如下表:
反应前 | 反应后 |
玻璃管和红色粉末的总质量为37.3g | 玻璃管和固体物质的总质量为36.1g |
小组内小丁同学分析表中的数据后,得出红色粉末中氧元素的质量为___________。
A装置中发生反应的化学方程式__________
③小组内小林同学认为为了防止溶液倒吸,本实验停止加热前应先断开A和B的连接,你认为是否需要?为什么?___________
④实验后小组内有同学指出:上述装置未进行尾气的处理。于是有同学设计了用下图装置代替原装置,实验装置图中采用虚线框内的装置,其作用是____________
A.收集一氧化碳 B.吸收二氧化碳 C.检验二氧化碳

【题目】实验室常用下列装置来制取气体,并完成相关性质实验探究。回答有关问题:
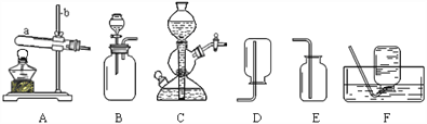
① 仪器a、b的名称是____________、 __________。
② 实验室用氯酸钾和二氧化锰混合共热制取一瓶干燥的氧气,需要选择的装置组合
是_________,化学方程式是____________。
③ 实验室用块状大理石和稀盐酸反应制取二氧化碳气体,选择的发生装置是C,该发生装置的名称叫___________,优点是__________,图示为反应的_____(填“进行”或“停止”)状态;充分反应后,向反应后的混合溶液中加入锌粒,产生气泡,则混合溶液中的溶质成分为________(填写化学式)。
④ 同学们在进行实验探究时发现很多因素都会对实验结果产生影响。
实验 | 分析与结论 |
Ⅰ.硫在空气中燃烧发出微弱的淡蓝色火焰, 硫在氧气中燃烧发出______________。 | 说明反应物的浓度不同,反应现象不同。 |
Ⅱ.细铁丝在氧气中易燃烧,化学方程式是________, 粗铁丝在氧气中不易燃烧。 | 说明_____________, 反应的速率不同。 |
Ⅲ.碳在氧气不足的条件下燃烧生成一氧化碳, 碳在氧气充足的条件下燃烧生成二氧化碳。 | 说明反应物的用量不同,________。 |