��Ŀ����
����Ŀ��ijУ��ѧ��ȤС���ڲμ����ʵ���ʱ���������һʪ��ұͭ���ŷŵķ�ˮ�к������������ͭ������Ⱦ�Ϊ�ⶨ�÷�ˮ�и���Ⱦ��ĺ�������ұͭ���ṩ������ˮ�IJο����������ͬѧ����������ʵ�飺ȡ��ˮ300g�������м���������������Ϊ20%������������Һ����ó��������������������������Һ��������ϵ��ͼ����������㣺
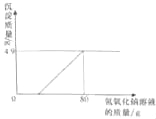
��1��ʵ��������������ͭ������Ϊ g��
��2��300g�÷�ˮ������ͭ��������
��3���÷�ˮ�������������������������������ȷ��0.1%��
���𰸡�
��1��4.9
��2�� 8g
��3�� 14.7%
��������
���������
��1���ɷ�Ӧͼ���е����߿ɵ�֪ǡ����ȫ��Ӧʱ���ɳ���4.9g��
��2����300g��ˮ��CuSO4������Ϊx����CuSO4��Ӧ��NaOH��Һ������Ϊy��
CuSO4+2NaOH=Cu��OH��2��+Na2SO4
160 80 98
x y��20% 4.9g
![]()
x=8g
y=20g
��300g�÷�ˮ��H2SO4������Ϊz
H2SO4+2NaOH=Na2SO4+2H2O
98 80
z ��80g��20g����20%
![]()
z=14.7g
�÷�ˮ�������������������=![]() 100%=4.9%��
100%=4.9%��

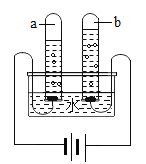
����Ŀ��С��ͬѧ���������ڳ�����ʳ�ü�ˮ�����ϸ���ʱ���ϸ���ҶƬ��Ե�����̣��е��ܺ��档�ص�ѧУ����ʦ�İ����½��ϸ���֭�ֱ�μӵ����е��������Ũ�ȵ�������Һ�У��ϸ���֭��ʾ����ɫ���±���
���� | ��ϡ | �� | �� | �� | �� |
��ɫ | ��ɫ | ����ɫ | ��ɫ | ��ɫ | ��ɫ |
[��������]
| <7 | 7 | 7.5-9 | 10-11.9 | 12-14 |
��ɫ | ��ɫ | ����ɫ | ��ɫ | ��ɫ | ��ɫ |
[�����ʶ]
��1���ϸ���֭�������ָʾ����
��2������������Һ��![]() ֵ�ɴ�С��˳��___������ţ���
ֵ�ɴ�С��˳��___������ţ���
[ʵ��̽��]Ϊ�˱��ڹ۲�ʵ��������ʦ��������ϡ�����к�����������ҺʱӦѡ�÷�̪��Һ��ָʾ������С�����ȤС���ͬѧ������ʵ��ʱ������ָʾ�������δ�۲쵽����������÷�Ӧ�Ļ�ѧ����ʽΪ______��
[�������]��Ӧ����Һ�����ʵijɷ�����Щ��
[�������]����һ��![]() ��������
��������![]() ��_________
��_________
�������![]() ��
��![]() �����ģ�
�����ģ�![]() ��
��![]() ��
��![]()
��ȤС���ͬѧһ����Ϊ�����IJ�������ԭ����__________��
[���ʵ��]
���� | ���� | ���� | |
����һ | ȡ��Ӧ�����Һ���Թ��У������еμ���ɫʯ����Һ�� | ʯ����Һ��� | ���������� |
������ ��дһ�֣� | _______ | _________ | |
������ | ȡ��Ӧ�����Һ���Թ��У������м������� | ������ɫ���� |
[���۽���]���������������У�ԭ����__________��
[��չӦ��]����θ�����ʱ����_________���ơ�����ѧʽ����дһ�֣�
����Ŀ����14.0g����һ������������ȼ�գ���¼�������ݣ�
ʵ����� | 1 | 2 | 3 |
����������/g | 4.5 | 14.0 | 18.0 |
�������������/g | 9.0 | 28.0 | 28.0 |
�������ݣ��ش��������⣮
��1����������ʵ���У���_____�θպ���ȫ��Ӧ��
��2���ڵ�_____��ʵ��������ʣ�࣬ʣ��_____g���ڵ�_____��ʵ����������ʣ�࣬ʣ��_____g������ʣ�������ʣ���������ȼ�գ������ɶ�������_____g��