题目内容
【题目】根据下列实验装置图回答问题:
E F
F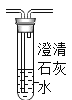 G
G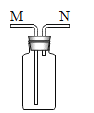
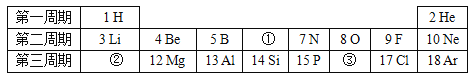
(1)写出图中仪器a的名称:_____。
(2)实验室可利用装置F来检验生成的二氧化碳,其现象为澄清石灰水变浑浊,请写出有关的化学方程式:_____。
(3)若用G装置来去除CO中混有的少量CO2,则该装置中最好加入下列哪种试剂?_____(填字母序号),混合气体应从_____(填“M”或“N”)端导管口进入。
A 浓硫酸
B 紫色石蕊溶液
C 氢氧化钠溶液
【答案】水槽 Ca(OH)2+CO2==CaCO3↓+H2O C M
【解析】
(1)写出图中仪器a的名称:水槽。
(2)实验室可利用装置F来检验生成的二氧化碳,其现象为澄清石灰水变浑浊,二氧化碳与氢氧化钙反应产生碳酸钙沉淀和水的化学方程式:Ca(OH)2+CO2==CaCO3↓+H2O。
(3)A、浓硫酸与二氧化碳不反应,不能除去二氧化碳气体;
B、紫色石蕊溶液,不能用于除去二氧化碳气体;
C、氢氧化钠溶液能与二氧化碳反应产生碳酸钠和水,可以除去二氧化碳气体;
故选:C。
混合气体应“长管进、短管出”从M端导管口进入万能瓶,进行洗气。

【题目】某化学兴趣小组将光亮铜片放在酒精灯火焰上灼烧,发现表面变黑,他们对黑色物质的成分产生了兴趣,铜片表面的黑色物质是什么呢?
(查阅资料)
(1)酒精不充分燃烧产生炭黑(即黑烟);
(2)氧气的化学性质比较活泼,加热条件下能与金属铜反应生成黑色的氧化铜。
(3)氧化铜能与稀硫酸反应生成硫酸铜和水;炭黑难溶于水,且与稀硫酸不发生反应。
(猜想与假设)
猜想1:黑色物质是炭黑。
猜想2:黑色物质是空气中的氧气与铜反应生成的氧化铜。
猜想3:黑色物质既有炭黑又有氧化铜。
(进行实验)
实验步骤 | 实验现象 |
实验一:取一小段光亮铜片,放入试管内,然后用试管夹夹持试管,放在酒精灯的外焰部位加热 | 铜片变黑 |
实验二:取一支试管,将一小段光亮铜片放入试管中,塞上胶塞,并用注射器抽出试管内的空气,封好胶塞,并加热,趁热取下胶塞,观察现象 | 打开胶塞前铜片不变黑;打开胶塞后铜片变黑 |
实验三:将在酒精灯火焰上灼烧后的附着黑色物质的铜片,投入到盛有足量稀硫酸的试管中 | 试管中没有黑色物质剩余,溶液由无色变为蓝色 |
(解释与结论)
(1)由实验可知,猜想________成立。
(2)实验二用注射器抽出试管内空气的目的是_________。
(3)通过对黑色物质来源的探究,金属铜与氧气反应的化学方程式是_________
(4)通过实验一和实验三都能得出猜想1和猜想3不正确,两个实验是从两个角度进行设计实验方案的,实验一是从____________的角度探究;实验三是从_____________的角度探究。
(反思拓展)
(5)实验一为什么能将猜想1和猜想3同时排除呢?你认为依据是_____________________。
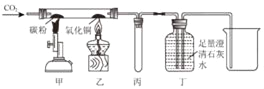
【题目】理科实验操作考试中,小明同学在做铝和稀盐酸反应时无意中加入几滴硫酸铜溶液,发现铝片表面产生气泡速率明显增快,对此他产生了兴趣。
(提出问题)硫酸铜溶液是不是此反应的催化剂?硫酸铜溶液的体积对此实验有影响吗?
(设计并实验)室温下,小明将过量、表面积相同已打磨的铝片分别加入到6份30mL10%稀盐酸中,并在每份中加入不同体积的硫酸铜饱和溶液,记录获得相同体积氢气的时间,从而确定产生氢气的速率。
实验混合溶液 | 1 | 2 | 3 | 4 | 5 | 6 |
饱和硫酸铜溶液/mL | 0 | 0.5 | 2.5 | 5 | 10 | 20 |
水/mL | 20 | 19.5 | 17.5 | V | 10 | 0 |
(1)如表表格中V=____________;
(2)写出铝和稀盐酸反应的化学方程式____________:
(3)定量收集氢气体积可用如图____________(填写字母序号)装置。
(实验现象)随着硫酸铜溶液体积的增加,产生氢气的速率先加快后明显减慢,且铝片表面附着的红色物质逐渐增加。
(结论与解释)
(4)随着硫酸铜体积的增加,反应速率明显变慢可能的原因是____________;
(5)根据实验现象小明认为硫酸铜溶液不是此反应的催化剂,其原因是____________;
(实验反思)加速铝和稀硫酸反应速率还可以采取的措施是(写出一点)____________
(若正确回答下列小题奖励4分,化学试卷不超过60分)
(实验拓展)根据上述实验,小明认为是盐中的金属离子影响了铝和稀盐酸的反应速率;为了研究不同金属离子对反应的影响,小明同学继续实验,取过量表面积相同的铝片和30mL10%稀盐酸混合后加入不同的盐溶液,实验现象如表(加号越多,代表反应速率越快):
实验1 | 实验2 | 实验3 | 实验4 | 实验5 | |
加入试剂0.5mL | 水 | 5%NaCl溶液 | 5%Mg(NO3)2溶液 | 5%FeSO4溶液 | 5%CuSO4溶液 |
产生气泡速率 | + | + | + | ++ | +++ |
(6)如表中,用水进行实验的目的___;
(7)上述实验设计存有缺陷,该缺陷是___;实验改进后,任符合上表中的实验现象,可得到的实验结论是:①____________;②____________.
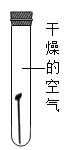
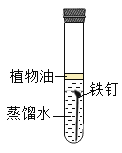
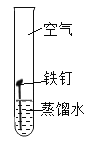
【题目】某研究小组为探究“铁钉生锈的条件及其影响铁钉锈蚀快慢的因素”,设计如下实验。
(查阅资料)已知稀氨水的pH>7;稀醋酸pH<7。
(实验1)铁锈蚀条件的探究。
试验序号 | 1 | 2 | 3 |
装置 |
|
|
|
试验现象 | 不生锈 | 不生锈 | 生锈 |
(实验2)取同浓度的稀氨水和稀醋酸用如图装置进行实验,实验数据如下表。
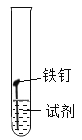
实验序号 | 2-1 | 2-2 | 2-3 | 2-4 | 2-5 |
温度/℃ | 25 | 25 | 25 | 70 | 70 |
试剂 | 水 | 稀氨水 | 稀醋酸 | 稀氨水 | 稀醋酸 |
出现铁锈所需时间 | 2天出现锈蚀/p> | 2天未见锈蚀 | 5分钟 | 2天未见锈蚀 | 1分钟 |
(解释与结论)
(1)实验1中得到铁生锈的条件是________。
(2)欲探究温度对铁制品锈蚀快慢的影响,应选择的实验是______(填实验序号)。
(3)根据实验2表中实验现象得出的结论是________。
(反思与评价)
(4)你觉得影响铁制品锈蚀快慢除上述因素外,还可能有________(写出1点即可),请设计实验方案证明_____________。