题目内容
化学兴趣小组同学在综合实践活动中了解到,某石灰厂有一批石灰石原料,其中含有的杂质是二氧化硅(二氧化硅不溶于水,不能与酸反应,高温时不分解).为了测定该石灰石的纯度,兴趣小组同学取30g这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸200g等分4次加入,每次充分反应后,经过滤、干燥后称量,剩余固体的质量见下表:
| 实验序号 有关数据 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体的质量/g | 20 | 10 | 6 | 6 |
(1)石灰石样品中所含杂质的质量为________g;
(2)第一次实验中产生二氧化碳的质量为多少?
(3)所用稀盐酸中溶质的质量分数是多少?
解:(1)由表中的数据可知,第三次与第四次反应后剩余固体质量相等,说明,第三次时碳酸钙已是完全反应,剩余的固体为杂质,杂质的质量为6g
(2)第一次实验消耗石灰石样品中碳酸钙的质量为:30g-20g=10g,
第一次消耗稀盐酸的质量为: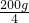 =50g
=50g
设第一次消耗50g稀盐酸中氯化氢的质量为x,生成二氧化碳的质量为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
10g x y
 =
=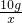 x=7.3g
x=7.3g
 =
=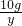 y=4.4g
y=4.4g
(3)所用稀盐酸中溶质氯化氢的质量分数为:
 =14.6%
=14.6%
答(1)石灰石样品中所含杂质的质量为6g;(2)第一次实验中产生二氧化碳的质量为4.4g;(3)所用稀盐酸中溶质的质量分数是14.6%.
分析:(1)根据表中的数据可知,第三次与第四次反应后剩余固体质量相等,说明,第三次时碳酸钙已是完全反应,剩余的固体为杂质;
(2)根据碳酸钙与盐酸反应的方程式,由第一次消耗的碳酸钙的质量可求出生成的二氧化碳及消耗的盐酸溶液中的溶质的质量;
(3)根据溶质质量分数的计算公式进行计算.
点评:此题是考查学生对图表的分析能力,并利用分析结果进行计算.关键是把握住完全反应的数据,利用有用的数据进行计算.
(2)第一次实验消耗石灰石样品中碳酸钙的质量为:30g-20g=10g,
第一次消耗稀盐酸的质量为:
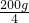 =50g
=50g 设第一次消耗50g稀盐酸中氯化氢的质量为x,生成二氧化碳的质量为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
10g x y
 =
=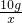 x=7.3g
x=7.3g  =
=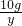 y=4.4g
y=4.4g (3)所用稀盐酸中溶质氯化氢的质量分数为:
 =14.6%
=14.6% 答(1)石灰石样品中所含杂质的质量为6g;(2)第一次实验中产生二氧化碳的质量为4.4g;(3)所用稀盐酸中溶质的质量分数是14.6%.
分析:(1)根据表中的数据可知,第三次与第四次反应后剩余固体质量相等,说明,第三次时碳酸钙已是完全反应,剩余的固体为杂质;
(2)根据碳酸钙与盐酸反应的方程式,由第一次消耗的碳酸钙的质量可求出生成的二氧化碳及消耗的盐酸溶液中的溶质的质量;
(3)根据溶质质量分数的计算公式进行计算.
点评:此题是考查学生对图表的分析能力,并利用分析结果进行计算.关键是把握住完全反应的数据,利用有用的数据进行计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
