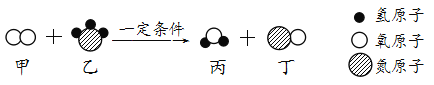
题目内容
下列化肥中属于复合肥料的是( )
A.KNO3 B.CO(NH2)2 C.Ca(H2PO4)2 D.NH4HCO3
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案学习复分解反应发生条件时,小红同学做了下表中的四个实验。
试管编号 | ① | ② | ③ | ④ |
试管内试剂 | NaOH溶液 | MgCl2溶液 | Na2CO3溶液 | Ba(NO3)2溶液 |
加入硫酸后的现象 | 无明显现象 | 无明显现象 | 产生气泡 | 白色沉淀生成 |
(1)根据以上实验,可以判断试管③④中发生了复分解反应。试管③中反应的化学方程式为_________________________________。
(2)小明同学向盛有NaOH溶液的试管中先加了一种试剂,再加稀硫酸,从而能说明试管①中也发生了反应,这种试剂是___________。
(3)为了验证试管②中是否发生复分解反应,小明同学进行了如下探究。
[提出猜想]猜想1:试管②中没有发生复分解反应,溶液中有MgCl2,即Mg2+和Cl-同时存在溶液中。
猜想2:试管②中发生了复分解反应,溶液中无MgCl2。
老师提示SO42-会对Cl-的检验有干扰,需要先除去,小明根据老师的提示和自己的猜想提出了以下实验方案。
[设计方案]

沉淀A的化学式是___________。
老师评价该方案时指出:设计思路正确,但试剂选择有误,你认为应该将所选的试剂_______改成____________。
小明按照修改后的方案进行了实验,最后得出的结论是猜想1正确,则步骤Ⅱ、步骤Ⅲ中必然会观察到的现象是____________________。
[实验反思]小明反思进行步骤Ⅲ时,加NaOH溶液采用了滴加的方式,但没有立即观察到任何现象,你认为其中的原因是_______________________。
化学规律建立在实验基础之上,质量守恒定律可以用许多化学实验加以验证。

(1)小东同学按照课本上的实验进行验证(如图所示)。一段时间后,可以观察到铁钉表面出现_____,其反应的化学反应方程式为__,反应前后天平读数不变,但溶液颜色变化不明显。
(2)小东想既能验证质量守恒定律,又能更快地观察到溶液颜色的变化,提出了以下设想:
(提出设想)设想一:增大硫酸铜溶液的浓度
设想二:用更活泼的金属锌代替铁钉
(实验验证)小东将以上实验进行了如下改进:
实验内容 | 实验现象 | |
实验1 | 烧杯中换成饱和硫酸铜溶液 | ①几小时后溶液颜色几乎不变 ②天平读数不变 ③铁钉表面有变化 |
实验2 | 铁钉换成锌粒 | ①溶液颜色明显变浅 ②天平读数减小 ③锌粒表面有变化 |
(实验分析)(3)从以上现象分析,两个设想都不合适,其中按设想_____(填“一”或“二”)进行的实验能够验证质量守恒定律。
(4)实验1中溶液颜色几乎不变的原因可能是_____(填序号)。
A 铁与饱和硫酸铜溶液不反应
B 铁表面形成了一层氧化膜,阻止了反应的进一步进行
C 生成的铜快速沉积在铁表面,阻止了反应的进一步进行
D 水也参与了该反应,但饱和硫酸铜溶液中水太少
(5)实验2虽然很快观察到溶液颜色变化,但出现了反应后总质量减小的情况,老师提醒小东,硫酸铜溶液呈酸性,所以总质量减小的原因可能是____。
(6)小东通过反复实验和探究得出:向实验1的饱和硫酸铜溶液中加入等体积的水,将实验2中的烧杯换成如图所示装置,均能达到实验目的,但该装置中缺少一种物品,请你在装置图中画出____。