题目内容
【题目】现有某工厂生产出的一批Na2CO3产品中混有少量的NaCl,某兴趣小组同学为了测定该产品中Na2CO3的质量分数,设计了下列实验方案。
方案:样品(12g) ![]() 测定生成CO2的质量。
测定生成CO2的质量。
(1)本实验采用如图所示的装置,C中盛放的物质是。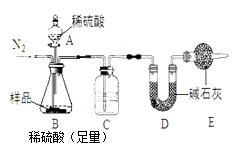
(2)装置E的作用为
(3)若把分液漏斗中的稀硫酸改为稀盐酸,在其他操作正确的情况下,(填“能”或“不能”)准确测定样品中Na2CO3的质量分数.
(4)反应结束后,持续通入N2作用为
(5)实验结束后测得装置D增重了4.4g,根据题意,计算样品中Na2CO3的质量分数(写出计算过程)。
【答案】
(1)浓硫酸
(2)防止空气中的水和二氧化碳进入
(3)不能
(4)将残留在装置中的二氧化碳赶入D装置进行吸收
(5)解:设碳酸钠的质量为x
Na2CO3+H2SO4=Na2SO4+H2O+ | CO2↑ |
106 | 44 |
x | 4.4g |
![]() =
=![]()
x=10.6g
则样品中碳酸钠的质量分数为![]() ×100%=88.3%
×100%=88.3%
【解析】(1)C中盛放的物质是浓硫酸,吸收水分,目的是消除水分的干扰。
装置E的作用为防止空气中的水和二氧化碳进入,使D装置增重;
若把分液漏斗中的稀硫酸改为稀盐酸,在其他操作正确的情况下,不能准确测定样品中Na2CO3的质量分数,因为盐酸具有挥发性,气体中可能混有氯化氢气体.反应结束后,持续通入N2作用为将残留在装置中的二氧化碳赶入D装置进行吸收。
(2)解:设碳酸钠的质量为x
Na2CO3+H2SO4=Na2SO4+H2O+ | CO2↑ |
106 | 44 |
x | 4.4g |
![]() =
=![]()
x=10.6g
则样品中碳酸钠的质量分数为![]() ×100%=88.3%
×100%=88.3%
【考点精析】解答此题的关键在于理解书写化学方程式、文字表达式、电离方程式的相关知识,掌握注意:a、配平 b、条件 c、箭号.

练习册系列答案
相关题目