��Ŀ����
����Ŀ����ͼ��ʾΪʵ�����г��������Ʊ�������������ռ�������ʵ��IJ���������ijѧУ������ѧʵ��̽���С���ͬѧ����������ɸ��Ե�̽��ʵ�飮 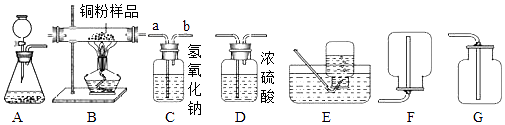
��1����һ���ͬѧ��п����ϡ����Ϊԭ�ϣ���ʵ�������Ʊ����ռ����﴿���������� ����ѡ����������˳��Ϊ����д���������ĸ����
������A�з�����Ӧ�Ļ�ѧ����ʽΪ ��
��װ��C�������� ��
��2���ڶ����ͬѧ��H2O2��ҺΪԭ�ϣ�MnO2���������Ʊ�������������������ⶨij10gͭ����Ʒ�Ĵ��ȣ�����Ʒ��ֻ��ͭ��̼������ѡ����������˳��ΪA��D��B��C���� ����������a����b�����˽���װ��C�����ڷ�Ӧ�Ļ�ѧ����ʽ�� ��
�������ղ��װ��C ����4.4g����ԭ��Ʒ������ͭ������������ �� װ��B�д����������ʵ��������ȷ�Ӧǰ���������С�������䡱֮һ����
���𰸡�
��1��ACDF��Zn+2HCl�TZnCl2+H2���������Ȼ�������
��2��a��CO2+2NaOH�TNa2CO3+H2O��8.8%������
���������⣺����ͼΪʵ�����г����������Ʊ�������ռ�������ʵ��IJ�����������֪����1����ijͬѧ��п����ϡ����Ϊԭ����ʵ�����Ʊ����ռ����������������������Ȼ������塢�����ѡװ�õ�����˳��Ϊ ACDF���ڸ�ͬѧ�Ʊ�����������Ӧ�Ļ�ѧ����ʽ Zn+2HCl�TZnCl2+H2������װ��C�������dz����Ȼ������壻��2������H2O2��Һ��MnO2��ʵ�������Ʊ�������������������ⶨBװ����ʢ�е�Cu��C�������Cu�ĺ�����ȡag�������Ʒ����װ��B��Ӳ�ʲ������У���ѡ��������˳��Ϊ��A��D��B��C������ͼ����������֪���������a��ͨ��C����C��������̼��Ӧ���ɵĶ�����̼���������Ʒ�Ӧ������ʽΪ��CO2+2NaOH�TNa2CO3+H2O���ڸ��ݡ������ղ��װ��C ����4.4g��������̼��������Ӧ����4.4g������̼�� ������4.4g������̼����̼������Ϊx����
C+O2 | CO2 |
12 | 44 |
x | 4.4g |
![]()
x=1.2g
��10g��Ʒ�к�ͭ10g��1.2g=8.8g��ԭ��Ʒ������ͭ����������= ![]() ��100%=88%��
��100%=88%��
Bװ���з�Ӧ�������Ϊ����ͭ��CuO��ͭԪ������Ԫ�ص�������Ϊ��64��16=4��1����8.8gͭ������2.2g������Ӧ������11g����ͭ����װ��B�д����������ʵ��������ȷ�Ӧǰ����
���Դ��ǣ���1����ACDF����Zn+2HCl�TZnCl2+H2�����۳����Ȼ������壻��2����a��CO2+2NaOH�TNa2CO3+H2O�� ��8.8%������
�����㾫�����������⣬������Ҫ�˽���������ȡװ��(����װ�ã��̹̼����͡���Һ��������)����Ҫ�����������ռ�����(�ռ�װ�ã��������ʵ��ܶȡ��ܽ��ԣ���ˮ���ռ�ʱ�������ݾ�������ð��ʱ���ռ����տ�ʼ�ų������Թ��еĿ����������ſ������ռ�����ʱ�������쵽����ƿ�ײ�)�����֪ʶ���Ǵ���Ĺؼ���

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�