题目内容
【题目】水是一种重要的资源,请结合所学知识,回答下列问题:
(1)我国水资源丰富,但分布不均,节约用水,人人有责。下列不属于节水措施的是_____(填字母)。
A 使用节水龙头 B 洗衣服的水用来冲厕所
C 淘米的水用来浇花 D 公园草坪用大水漫灌
(2)硬水会对人们的日常生活造成不良影响,因此在生活中通常用_____的方法把硬水转化为软水。某同学发现长时间烧煮自来水的水壶中有水垢,他用厨房里的_____(填字母)轻松将水垢除去。
A 食盐水 B 食醋 C 料酒 D 糖水
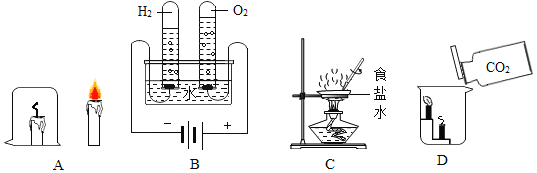
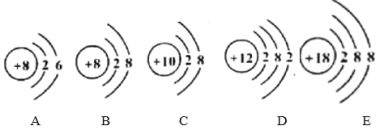
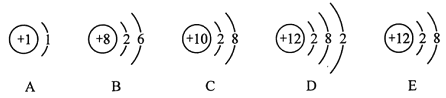
(3)电解水实验如图所示:
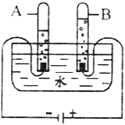
①该实验中生成氢气和氧气的体积比约为_____;
②从宏观角度看,该实验证明水是由_____组成的。
(4)氢化镁固体(化学式为![]() )是一种贮氢合金,当它与
)是一种贮氢合金,当它与![]() 混合时释放出氢气,同时生成一种碱,写出该反应的化学方程式_____。
混合时释放出氢气,同时生成一种碱,写出该反应的化学方程式_____。
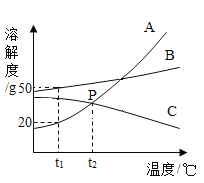
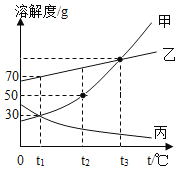
(5)请根据下图![]() 、
、![]() 、
、![]() 三种固体物质的溶解度曲线,回答下列问题:
三种固体物质的溶解度曲线,回答下列问题:
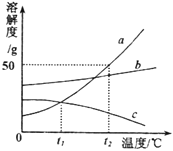
①除去![]() 物质中混有的少量
物质中混有的少量![]() 物质,最好采用_____(填“降温结晶”或“蒸发结晶”)的方法提纯。
物质,最好采用_____(填“降温结晶”或“蒸发结晶”)的方法提纯。
②下列说法正确的是_____(填字母)。
A 将![]() 物质的饱和溶液变为不饱和溶液,其溶质的质量分数一定减小
物质的饱和溶液变为不饱和溶液,其溶质的质量分数一定减小
B 将![]() 时
时![]() 物质的饱和溶液升温到
物质的饱和溶液升温到![]() ,其溶液的质量一定减小
,其溶液的质量一定减小
C ![]() 时
时![]() 物质和
物质和![]() 物质的饱和溶液所含溶质的质量不一定相等
物质的饱和溶液所含溶质的质量不一定相等
【答案】![]() 煮沸
煮沸 ![]()
![]() 氢元素和氧元素
氢元素和氧元素 ![]() 降温结晶
降温结晶 ![]()
【解析】
(1)公园草坪用大水漫灌不属于节水措施,故填:D;
(2)生活中通常用煮沸的方法把硬水转化为软水,水壶中有水垢,水垢的成分通常是碳酸钙和氢氧化镁,所以可用厨房里的食醋除去,故填:煮沸 B;
(3)通电电解水时,生成氢气和氧气的体积比约为2:1,从宏观角度看水是由氢元素和氧元素组成,故填:2:1 氢元素和氧元素;
(4)氢化镁与水反应生成氢氧化镁和氢气,所以化学方程式为:MgH2+2H2O=Mg(OH)2+2H2↑,故填:MgH2+2H2O=Mg(OH)2+2H2↑;
(5)①由图知,a是陡升型的,b是缓升型的,a中有少量b时,通常采用降温结晶的方法提纯,故填:降温结晶;
②A.将a物质的饱和溶液变为不饱和溶液,可通过升温的方式实现,所以其溶质的质量分数不一定减小,故不符合题意;
B.将t1℃时c物质的饱和溶液升温到t2℃时,由于c的溶解度随温度的升高而减小,所以饱和溶液升温时c会有晶体析出,其溶液的质量会减小,故符合题意;
C.t1℃时a物质和c物质的饱和溶液所含溶质的质量不一定相等,因为两者的溶液质量不一定相等,故符合题意。故填:BC。

【题目】在研究“酸碱中和反应”时,某兴趣小组同学想证明稀盐酸与氢氧化钠溶液混合后是否发生了化学反应,进行了如下探究:
(1)在盛有氢氧化的溶液的烧杯中入几滴酚酞溶液,再逐滴加入稀盐酸,并不断搅拌(如图一)。用数字化传感器测得盐酸与氢氧化钠溶液混合前后的温度变化情况(如图二)。
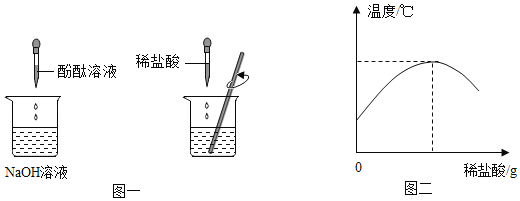
由实验现象和曲线变化情况分析可知,盐酸和氢氧化钠溶液发生了反应并_____(填“吸收”或“放出”)热量。
(2)从微观角度分析盐酸与氢氧化钠溶液的反应
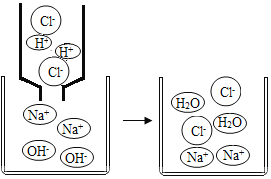
由如图可知,该反应的微观实质是_____。
(交流讨论)同学们讨论后认为,如果盐酸和氢氧化钠减少(或消失),或者有新物质生成,都能证明反应已经发生。
(3)探究实验后烧杯中溶质的成分。
步骤 | 现象 | 结论 |
实验1:取烧杯中的溶液少许于试管中,加入硫酸铜溶液 | _____ | 证明没有NaOH |
实验2;另取烧杆中的溶液少许于试管中,加入硝酸银溶液 | 出现白色沉淀 | 证明含有HCl |
实验3:再取烧杯中的溶液少许于蒸发皿中,加热蒸干 | 有_____产生 | 证明有NaCl生成 |
(得出结论)氢氧化钠溶液和盐酸发生了中和反应。
(评价反思)
Ⅰ.有同学认为,仅通过实验2出“溶液中含有HCl”证据不足,理由是_____。
Ⅱ.运用中和反应,可以解决生产,生活中的实际同题。如工厂用氨水(NH3H2O)处理废水中的硫酸,能得到一种氮肥一硫酸铵,写出该反应的化学方程式_____。
Ⅲ.多角度认识少学反应是学习化学的重变方法。