题目内容
实验室里某小组正在探究一个问题.根据设计方案,小英向试管中加入2mL氢氧化钠溶液,滴入几滴酚酞溶液,溶液显红色.然后她又用滴管连续滴入一定量的稀硫酸,溶液由红色变为无色.
(1)他们探究的问题是
Ⅰ.酚酞溶液遇酸、碱溶液能显示不同颜色吗?Ⅱ.酸和碱溶液能发生反应吗?
(2)大家对小英得到的无色溶液继续探究.小斌认为反应后溶液中的溶质是硫酸钠,小亮认为溶质有两种,它们是
(3)请你和全组同学一起分析以下问题.
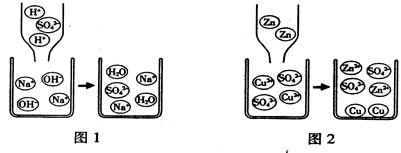
①稀硫酸和氢氧化钠溶液发生反应的微观过程如图1所示.从粒子的角度具体分析该反应能发生的原因是
②锌和硫酸铜溶液发生反应的微观过程如图2所示.从粒子的角度具体分析该变化是化学变化的原因是
(1)他们探究的问题是
Ⅱ
Ⅱ
(填Ⅰ或Ⅱ)Ⅰ.酚酞溶液遇酸、碱溶液能显示不同颜色吗?Ⅱ.酸和碱溶液能发生反应吗?
(2)大家对小英得到的无色溶液继续探究.小斌认为反应后溶液中的溶质是硫酸钠,小亮认为溶质有两种,它们是
硫酸钠和硫酸(或Na2SO4和H2SO4)
硫酸钠和硫酸(或Na2SO4和H2SO4)
.同学们根据以下两种方案进行实验后,一致认为小亮的观点是正确的.请你补填下表的空缺.| 实验操作 | 实验现象 | 实验结论 |
| 方案一:取少许反应后的 溶液置于试管中,向其中加入石蕊试液 |
溶液显红色 溶液显红色 |
小亮的观点正确 |
| 方案二:取少许反应后的溶液置于试管中,向其中加入 锌 锌 |
产生气泡 产生气泡 |

①稀硫酸和氢氧化钠溶液发生反应的微观过程如图1所示.从粒子的角度具体分析该反应能发生的原因是
氢离子和氢氧根离子反应生成了水分子
氢离子和氢氧根离子反应生成了水分子
.②锌和硫酸铜溶液发生反应的微观过程如图2所示.从粒子的角度具体分析该变化是化学变化的原因是
反应前的锌原子和铜离子变成了锌离子和铜原子
反应前的锌原子和铜离子变成了锌离子和铜原子
.分析:(1)分析实验操作,判断探究的实验目的;
(2)设计实验方案,检验反应后溶液中含有硫酸,根据硫酸能使酸碱指示剂变色,能与活泼金属反应放出气体进行解答;
(3)分析变化前后的微观过程图,从粒子的角度解释所发生的变化原因,并总结成规律.
(2)设计实验方案,检验反应后溶液中含有硫酸,根据硫酸能使酸碱指示剂变色,能与活泼金属反应放出气体进行解答;
(3)分析变化前后的微观过程图,从粒子的角度解释所发生的变化原因,并总结成规律.
解答:解:(1)向加有无色酚酞的氢氧化钠溶液中滴加稀硫酸,至红色消失;此操作说明在探究酸与碱能否发生的中和反应;
故答案为:Ⅱ;
(2)如果硫酸滴加过量,反应后的溶液呈酸性,酚酞也会呈无色,这样一来反应后溶液为硫酸钠和硫酸的混合溶液;
故答案为:硫酸钠和硫酸(或Na2SO4和H2SO4);
方案一:滴加紫色石蕊试液),若溶液变成红色,则含有硫酸;
故答案为:溶液变成红色;
方案二:加入金属锌,若有气泡生成,则含有硫酸;
故答案为:锌;产生气泡;
(3)①变化前的微粒有:H+、SO42-、Na+、OH-,而反应后的微粒有:H2O、Na+、SO42-,则可判断反应实际上是H+与OH-反应生成H2O分子;
故答案为:氢离子和氢氧根离子反应生成了水分子;
②变化前的微粒有:Zn、SO42-、Cu2+,而反应后的微粒有:Cu、SO42-、Zn2+,则可判断反应实际上是Zn→Zn2+、Cu2+→Cu的过程;
故答案为:反应前的锌原子和铜离子变成了锌离子和铜原子;
故答案为:Ⅱ;
(2)如果硫酸滴加过量,反应后的溶液呈酸性,酚酞也会呈无色,这样一来反应后溶液为硫酸钠和硫酸的混合溶液;
故答案为:硫酸钠和硫酸(或Na2SO4和H2SO4);
方案一:滴加紫色石蕊试液),若溶液变成红色,则含有硫酸;
故答案为:溶液变成红色;
方案二:加入金属锌,若有气泡生成,则含有硫酸;
故答案为:锌;产生气泡;
(3)①变化前的微粒有:H+、SO42-、Na+、OH-,而反应后的微粒有:H2O、Na+、SO42-,则可判断反应实际上是H+与OH-反应生成H2O分子;
故答案为:氢离子和氢氧根离子反应生成了水分子;
②变化前的微粒有:Zn、SO42-、Cu2+,而反应后的微粒有:Cu、SO42-、Zn2+,则可判断反应实际上是Zn→Zn2+、Cu2+→Cu的过程;
故答案为:反应前的锌原子和铜离子变成了锌离子和铜原子;
点评:对比微观过程图前后的微粒的不同,找出变化前后微粒的改变,既可发现溶液中发生化学变化的实质.

练习册系列答案
相关题目


 实验测试部分
实验测试部分