题目内容
新泰市资源丰富,现已探明的矿种有:煤矿、铁矿、萤石矿、石灰石…
(1)煤被称为“工业的粮食”,它属于 (填“可再生”或“不可再生”)能源.
(2)萤石的主要成分是氟化钙(CaF2).CaF2中氟元素显 价.
(3)炼铁的原理之一是:高温下用一氧化碳把赤铁矿(主要成分为Fe2O3)中的铁还原出来.其化学方程式为 .
(4)石灰石通过以下转化可得烧碱:石灰石
生石灰
熟石灰
烧碱转化③的化学方程式为 .
(1)煤被称为“工业的粮食”,它属于
(2)萤石的主要成分是氟化钙(CaF2).CaF2中氟元素显
(3)炼铁的原理之一是:高温下用一氧化碳把赤铁矿(主要成分为Fe2O3)中的铁还原出来.其化学方程式为
(4)石灰石通过以下转化可得烧碱:石灰石
| 高温 |
| ① |
| 水 |
| ② |
| 碳酸钠 |
| ③ |
考点:化石燃料及其综合利用,铁的冶炼,碳酸钙、生石灰、熟石灰之间的转化,有关元素化合价的计算,书写化学方程式、文字表达式、电离方程式,常见能源的种类、能源的分类
专题:化学式的计算,化学与能源,化学用语和质量守恒定律
分析:(1)煤、石油和天然气属于化石燃料,是不可再生能源;
(2)化合物中,元素的化合价代数和为零;
(3)氧化铁和一氧化碳在高温条件下反应生成铁和二氧化碳;
(4)熟石灰的氢氧化钙的俗称,氢氧化钙能和碳酸钠反应生成碳酸钙沉淀和氢氧化钠.
(2)化合物中,元素的化合价代数和为零;
(3)氧化铁和一氧化碳在高温条件下反应生成铁和二氧化碳;
(4)熟石灰的氢氧化钙的俗称,氢氧化钙能和碳酸钠反应生成碳酸钙沉淀和氢氧化钠.
解答:解:(1)煤被称为“工业的粮食”,它属于不可再生能源.
故填:不可再生.
(2)氟化钙中,钙元素的化合价是+2,设氟元素的化合价是x,
则有:(+2)×1+x×2=0,
x=-1,
故填:-1;
(3)氧化铁和一氧化碳反应的化学方程式为:Fe2O3+3CO
2Fe+3CO2.
故填:Fe2O3+3CO
2Fe+3CO2.
(4)熟石灰和碳酸钠反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
故填:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
故填:不可再生.
(2)氟化钙中,钙元素的化合价是+2,设氟元素的化合价是x,
则有:(+2)×1+x×2=0,
x=-1,
故填:-1;
(3)氧化铁和一氧化碳反应的化学方程式为:Fe2O3+3CO
| ||
故填:Fe2O3+3CO
| ||
(4)熟石灰和碳酸钠反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
故填:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
点评:书写化学方程式要注意四步:一是反应物和生成物的化学式要正确;二是要遵循质量守恒定律,即配平;三是要有必要的条件;四是看是否需要“↑”或“↓”.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
加热氯酸钾时,忘记加二氧化锰会造成( )
| A、放出氧气总量减少 |
| B、无氧气放出 |
| C、放出氧气的速度慢 |
| D、放出氧气的速度慢且量少 |
相同质量的SO2与SO3中,氧元素的质量比是( )
| A、2:3 | B、1:1 |
| C、5:6 | D、7:12 |
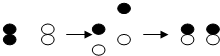 如图表示氢气(H2)和氯气(Cl2)反应生成氯化氢(HCl)的示意图,根据以下信息回答:
如图表示氢气(H2)和氯气(Cl2)反应生成氯化氢(HCl)的示意图,根据以下信息回答: