题目内容
【题目】将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,用温度计测出烧杯中溶液的温度,溶液温度随加入稀盐酸质量增加而发生变化,如下图所示。有关叙述中错误的是( )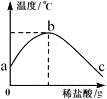
A.b点表示氢氧化钠和盐酸恰好完全反应
B.c点表示反应所得溶液中溶质只有NaCl
C.从a到b过程中,烧杯中溶液的pH逐渐增大
D.稀盐酸与氢氧化钠溶液发生的反应是放热反应
【答案】B,C
【解析】根据NaOH+HCl=NaCl+H2O,结合图象分析。由图像可以看出,随着稀盐酸的不断加入,溶液的温度在逐渐的升高,由此可知,盐酸与氢氧化钠的反应是放热反应,故D正确;而在b点,由于温度达到最高了(不再上升),说明氢氧化钠此时恰好反应完,即二者在b点恰好完全反应,故A正确;根据上面的分析,在c点盐酸已过量,故此时反应所得溶液中的溶质除了有生成的NaCl外,还有剩余的盐酸,故B错误;根据图像,从a到b过程中,随着盐酸的加入,氢氧化钠在逐渐减少,故pH值会逐渐减小,故C错误。
故答案为:BC。
根据中和反应分析,氢氧化钠和盐酸反应放热,恰好反应时溶液呈中性,pH=7,若酸有剩余则溶液呈酸性,pH<7,若碱有剩余则溶液呈碱性,pH>7.解答此类题时要注意审题,根据溶液pH的变化分析清楚是酸入碱还是碱入酸。

练习册系列答案
相关题目