题目内容
化学是一门以实验为基础的科学.我们常用下列仪器进行气体的制取实验,由此感受到化学的仪器美、现象美.
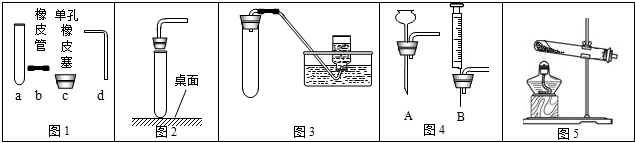
(1)若用一定质量的高锰酸钾制备并收集一瓶纯净的氧气.如图1中的仪器不需要使用的是
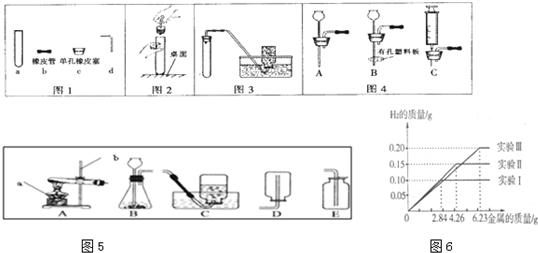
(2)请在如图2中画出试管中固体质量与反应时间的关系图.
(3)在清洗试管中的反应物残留物时,有的同学发现水溶液出现紫红色,有的发现水溶液呈墨绿色(锰酸钾溶于水
所致),且同时有黑色的粉末状固体.你对水溶液出现紫红色这一现象的解释是
(4)为了分离、回收反应残留物中的黑色粉末状固体,需对固液混合物溶液进行以下操作:
①取一张质量为ag的滤纸,制作并安装好过滤器.
②将上述固液混合物静置一会,过滤
③取沉淀连同滤纸放在干燥器中干燥后,称量,质量为bg.
过滤操作时,需将圆形滤纸折叠.下列滤纸折叠过程如图3,正确的是
甲:A→B→C 乙:A→B→D
过滤时除了选择上图中的部分仪器外,还需补充的一种玻璃仪器是
老师指出,②、③之间缺少一个步骤,该步骤是“洗涤沉淀”,否则会使所得黑色粉末的质量

(1)若用一定质量的高锰酸钾制备并收集一瓶纯净的氧气.如图1中的仪器不需要使用的是
FH
FH
(填字母),实验过程中发生反应的化学反应式为2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
;
| ||
(2)请在如图2中画出试管中固体质量与反应时间的关系图.
(3)在清洗试管中的反应物残留物时,有的同学发现水溶液出现紫红色,有的发现水溶液呈墨绿色(锰酸钾溶于水
所致),且同时有黑色的粉末状固体.你对水溶液出现紫红色这一现象的解释是
高锰酸钾没有分解完
高锰酸钾没有分解完
.(4)为了分离、回收反应残留物中的黑色粉末状固体,需对固液混合物溶液进行以下操作:
①取一张质量为ag的滤纸,制作并安装好过滤器.
②将上述固液混合物静置一会,过滤
③取沉淀连同滤纸放在干燥器中干燥后,称量,质量为bg.
过滤操作时,需将圆形滤纸折叠.下列滤纸折叠过程如图3,正确的是
甲
甲
甲(选填“甲”或“乙”).甲:A→B→C 乙:A→B→D
过滤时除了选择上图中的部分仪器外,还需补充的一种玻璃仪器是
漏斗
漏斗
,所得黑色固体的质量为(b-a)g
(b-a)g
.老师指出,②、③之间缺少一个步骤,该步骤是“洗涤沉淀”,否则会使所得黑色粉末的质量
偏大
偏大
(填“偏大”或“偏小”或“无影响”)分析:(1)根据高锰酸钾制备氧气用到的仪器和方程式的书写方法考虑;(2)根据高锰酸钾分解后生成物中固体质量的变化考虑;(3)根据高锰酸钾溶于水是紫红色考虑;(4)根据过滤器的制作方法,过滤时用到的仪器,两次称量的固体质量关系和不洗涤沉淀导致的结果考虑本题.
解答:解:(1)高锰酸钾制备并收集一瓶纯净的氧气,因为高锰酸钾是固体所以需要加热,需要铁架台、试管、酒精灯,集气瓶,导管,因为收集比较纯的氧气,要用排水法收集,还要用到水槽;反应物是高锰酸钾,生成物是锰酸钾、二氧化锰和氧气,用观察法配平,氧气后面标上上升符号,反应条件是加热;
(2)由于高锰酸钾分解后生成锰酸钾、二氧化锰和氧气,锰酸钾和二氧化锰还是固体,氧气是气体,所以随着反应的进行固体质量在不断减少,当反应完毕,固体质量不再减少,呈水平线了,因为反应后还有固体锰酸钾和二氧化锰,所以固体质量不会减少到零,图为: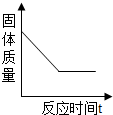
(3)水溶液出现紫红色是因为高锰酸钾没有完全反应,剩余的高锰酸钾溶于水,溶液颜色是紫红色;
(4)过滤器的制作方法:先对折一次,再对折一次,一边是三层,一边是一层;过滤时用到的玻璃仪器有:漏斗、烧杯、玻璃棒,所以缺少漏斗;沉淀连同滤纸放在干燥器中干燥后,称量,质量为bg,一张滤纸的质量为ag,所以所得黑色固体的质量为(b-a)g;如果不洗涤沉淀,固体中会混有锰酸钾固体,导致所得黑色粉末的质量偏大.
故答案为:(1)FH;2KMnO4
K2MnO4+MnO2+O2↑;(2)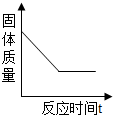 (3)高锰酸钾没有分解完;(4)甲;;漏斗;(b-a)g;偏大.
(3)高锰酸钾没有分解完;(4)甲;;漏斗;(b-a)g;偏大.
(2)由于高锰酸钾分解后生成锰酸钾、二氧化锰和氧气,锰酸钾和二氧化锰还是固体,氧气是气体,所以随着反应的进行固体质量在不断减少,当反应完毕,固体质量不再减少,呈水平线了,因为反应后还有固体锰酸钾和二氧化锰,所以固体质量不会减少到零,图为:

(3)水溶液出现紫红色是因为高锰酸钾没有完全反应,剩余的高锰酸钾溶于水,溶液颜色是紫红色;
(4)过滤器的制作方法:先对折一次,再对折一次,一边是三层,一边是一层;过滤时用到的玻璃仪器有:漏斗、烧杯、玻璃棒,所以缺少漏斗;沉淀连同滤纸放在干燥器中干燥后,称量,质量为bg,一张滤纸的质量为ag,所以所得黑色固体的质量为(b-a)g;如果不洗涤沉淀,固体中会混有锰酸钾固体,导致所得黑色粉末的质量偏大.
故答案为:(1)FH;2KMnO4
| ||
 (3)高锰酸钾没有分解完;(4)甲;;漏斗;(b-a)g;偏大.
(3)高锰酸钾没有分解完;(4)甲;;漏斗;(b-a)g;偏大.点评:解答本题关键是要知道高锰酸钾制取氧气用到的仪器,方程式的写法,过滤操作的注意事项和过滤器的制法,知道洗涤固体时是洗掉二氧化锰中溶于水的固体锰酸钾.

练习册系列答案
 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
 20、化学是一门以实验为基础的科学,规范的实验操作是实验成功的前提,请回答:
20、化学是一门以实验为基础的科学,规范的实验操作是实验成功的前提,请回答: