题目内容
(1)在非金属单质中,活泼性强的非金属可以把活泼性弱的非金属从溶液中置换出来.例如:Cl2+2NaBr=Br2+2NaCl Br2+2NaI=I2+2NaBr I2+Na2S=S↓+2NaI Cl2+2NaI=I2+2NaCl(友情提示:K、Na极易与冷水发生置换反应生成碱和氢气)
则下列方程式书写正确的是______
A.I2+2NaBr=2NaI+Br2 B.2Na+CuCl2=Cu+2NaCl
C.Cl2+Na2S=2NaCl+S↓ D.2Fe+3CuCl2=2FeCl3+3Cu
(2)“纳米铁”是具有很强活性其颗粒达到纳米级的单质.“纳米铁”也可以通过置换反应制取.在高温隔绝空气的条件下,以N2作保护气,用氢气还原氯化亚铁可生成纳米铁,反应的化学方程式为______ Fe+2HCl
【答案】分析:(1)根据物质的性质以及质量守恒定律、化学反应是否符合客观事实进行分析;
(2)根据反应物、生成物及反应条件写出反应的方程式;
(3)①根据核内质子数判断元素的种类,②根据离子结构示意图及n的取值范围,分析符合题意的微粒;
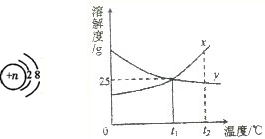
(4)①根据y的溶解度曲线进行分析将不饱和溶液变成饱和溶液的方法,②根据t1℃时x的溶解度进行计算.
解答:解:(1)A、Br2的活泼性大于I2,反应不能发生,故A错误.
B、钠是比较活泼的金属,能与水反应碱和氢气,故B错误;
C、由题意科知,Cl2的活泼性大于S,反应能发生,故C正确;
D、铁与氯化铜反应生成了氯化亚铁和铜,不符合客观事实,故D错误.
(2)在高温隔绝空气的条件下,以N2作保护气,用氢气还原氯化亚铁可生成纳米铁,反应的化学方程式为:H2+FeCl2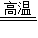 Fe+2HCl;
Fe+2HCl;
(3)①当n=10且为中性微粒时,该微粒为氖原子,元素符号为:Ne;
②当10<n<18,且为二价阳离子,该微粒的名称为镁离子;
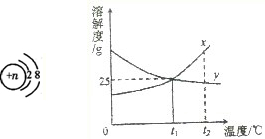
(4)①由y的溶解度曲线可知,y的溶解度随温度的升高而降低,所以,使y物质的不饱和溶液变成饱和溶液,可采用方法是升高温度,增加溶质,减少溶剂;
②t1℃时x的饱和溶液的质量分数为一定值,都可以根据t1℃时x的溶解度进行计算,所以,t1℃时96gx的饱和溶液的质量分数为: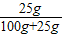 ×100%=20%
×100%=20%
故答为:(1)C;(2)H2+FeCl2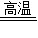 Fe+2HCl;(3)①Ne;②镁离子;(4)①C;②20%.
Fe+2HCl;(3)①Ne;②镁离子;(4)①C;②20%.
点评:本题所考查的知识比较多,但难度不大,可根据已有的知识进行分析回答.
(2)根据反应物、生成物及反应条件写出反应的方程式;
(3)①根据核内质子数判断元素的种类,②根据离子结构示意图及n的取值范围,分析符合题意的微粒;
(4)①根据y的溶解度曲线进行分析将不饱和溶液变成饱和溶液的方法,②根据t1℃时x的溶解度进行计算.
解答:解:(1)A、Br2的活泼性大于I2,反应不能发生,故A错误.
B、钠是比较活泼的金属,能与水反应碱和氢气,故B错误;
C、由题意科知,Cl2的活泼性大于S,反应能发生,故C正确;
D、铁与氯化铜反应生成了氯化亚铁和铜,不符合客观事实,故D错误.
(2)在高温隔绝空气的条件下,以N2作保护气,用氢气还原氯化亚铁可生成纳米铁,反应的化学方程式为:H2+FeCl2
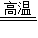 Fe+2HCl;
Fe+2HCl;(3)①当n=10且为中性微粒时,该微粒为氖原子,元素符号为:Ne;
②当10<n<18,且为二价阳离子,该微粒的名称为镁离子;
(4)①由y的溶解度曲线可知,y的溶解度随温度的升高而降低,所以,使y物质的不饱和溶液变成饱和溶液,可采用方法是升高温度,增加溶质,减少溶剂;
②t1℃时x的饱和溶液的质量分数为一定值,都可以根据t1℃时x的溶解度进行计算,所以,t1℃时96gx的饱和溶液的质量分数为:
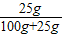 ×100%=20%
×100%=20%故答为:(1)C;(2)H2+FeCl2
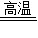 Fe+2HCl;(3)①Ne;②镁离子;(4)①C;②20%.
Fe+2HCl;(3)①Ne;②镁离子;(4)①C;②20%.点评:本题所考查的知识比较多,但难度不大,可根据已有的知识进行分析回答.

练习册系列答案
相关题目
 (1)在非金属单质中,活泼性强的非金属可以把活泼性弱的非金属从溶液中置换出来.例如:Cl2+2NaBr=Br2+2NaCl Br2+2NaI=I2+2NaBr I2+Na2S=S↓+2NaI Cl2+2NaI=I2+2NaCl
(1)在非金属单质中,活泼性强的非金属可以把活泼性弱的非金属从溶液中置换出来.例如:Cl2+2NaBr=Br2+2NaCl Br2+2NaI=I2+2NaBr I2+Na2S=S↓+2NaI Cl2+2NaI=I2+2NaCl (1)在非金属单质中,活泼性强的非金属可以把活泼性弱的非金属从溶液中置换出来.例如:Cl2+2NaBr=Br2+2NaCl Br2+2NaI=I2+2NaBr I2+Na2S=S↓+2NaI Cl2+2NaI=I2+2NaCl
(1)在非金属单质中,活泼性强的非金属可以把活泼性弱的非金属从溶液中置换出来.例如:Cl2+2NaBr=Br2+2NaCl Br2+2NaI=I2+2NaBr I2+Na2S=S↓+2NaI Cl2+2NaI=I2+2NaCl