题目内容
【题目】我国南海蕴藏着极为丰富的资源,在经济、国防上有重要意义。南海诸岛自古以来就是我国领土,我们要坚决捍卫在南海的主权。
(1)我们的食用盐大部分来自于海水,从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂质,为得到较纯的氯化钠,可以将粗盐溶于水,然后进行如下操作:
① 过滤
② 加过量的Na2CO3溶液
③ 适量的盐酸
④ 加过量的Ba(OH)2溶液
⑤ 蒸发。
正确的操作顺序是(填序号)。
(2)烧碱和氯气是重要的化工生产原料,我们可以利用海水为原材料大量制取。发生反应的化学方程式为:2NaCl + 2A ![]() 2 NaOH+ Cl2↑+H2↑, 则 A的化学式为。
2 NaOH+ Cl2↑+H2↑, 则 A的化学式为。
(3)如图是氯化钠、氢氧化钠两种固体物质的溶解度曲线。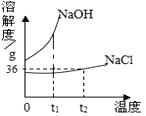
① t1℃ 时,NaOH饱和溶液的溶质质量分数NaCl饱和溶液的溶质质量分数(填“大于”、“小于”、“等于”之一)
② t2℃ 时,将 20gNaCl固体投入 50g水中,充分溶解后可得到NaCl的(填“不饱和溶液”或“饱和溶液”之一),此时所得溶液的质量是g。
【答案】
(1)④ ② ① ③ ⑤
(2)H2O
(3)大于,饱和溶液,68g
【解析】(1)要除去粗盐中含有的杂质,可以加过量的氢氧化钡溶液除去硫酸镁,加过量的Na2CO3溶液除去氯化钙和过量试剂氢氧化钡,通过过滤把不溶于水的物质除去,加适量的盐酸除去过量的碳酸钠,通过蒸发除去盐酸,即④ ② ① ③ ⑤(2)(2)根据质量守恒定律和氯碱工业中发生反应的化学方程式为:2NaCl+2A═2NaOH+Cl2↑+H2↑,反应前有;2Na、2Cl、,反应后有:2Na、4H、2Cl、2O,故2A中含有4个氢原子,两个氧原子,故化学式为:H2O(3)①饱和溶液中溶质的质量分数=溶解度/(100+溶解度)×100%,即溶解度大则溶质的质量分数大,t1℃时,NaCl的溶解度小于NaOH的溶解度,故NaCl饱和溶液中溶质质量分数小于NaOH饱和溶液中溶质质量分数;②t2℃时氯化钠的溶解度是36g,即100g水中最多溶解36g的氯化钠,所以将20g氯化钠固体投入50g水中只能溶解18g,所以得到的是NaCl的饱和溶液,溶液质量=18g+50g=68g。
故答案为:④ ② ① ③ ⑤;H2O;大于;饱和溶液;68g。
在溶解度曲线中,某点的定义是考试重点;根据图像比较溶解度的大小:温度相同,点高溶大,相交点表示物质溶解度相等。当杂质的溶解度随温度变化较大是,采用蒸发结晶,当杂质溶解度随温度变化较小时,冷却热饱和溶液结晶。



