题目内容
【题目】实验室现有硫酸镁和硫酸钠的固体混合物样品,小明同学想测定样品中硫酸镁的质量分数,先称取该混合物样品20g,完全溶于100g水中.然后取用了一定溶质质量分数的氢氧化钠溶液100 g平均分四次加入其中,充分振荡,实验所得数据见下表,请你分析并进行有关计算:
次数 | 1 | 2 | 3 | 4 |
加入氢氧化钠溶液的质量/g | 25 | 25 | 25 | 25 |
生成沉淀的质量/g | 2.9 | X | 8.7 | 8.7 |
(1)上表中X的数值为;原固体混合物样品中硫酸镁的质量分数是;
(2)求恰好完全反应时,溶液中溶质的质量分数.(结果精确到0.1%)
(3)请在图中画出在20g 样品中加氢氧化钠溶液的质量与产生沉淀质量变化关系的示意图. 
(4)若用氢氧化钡溶液代替氢氧化钠溶液来测定样品中硫酸镁的质量分数,是否可行?并说明理由 .
【答案】
(1)5.8;90%
(2)解:设恰好完全反应时生成Na2SO4的质量为x.
MgSO4+2NaOH═ | Mg(OH)2↓+ | Na2SO4 |
58 | 142 | |
8.7g | x |
![]() =
= ![]() ,解得x=21.3g
,解得x=21.3g
恰好完全反应时,溶液中溶质的质量分数为 ![]() ×100%=12.5%.
×100%=12.5%.
答:恰好完全反应时,溶液中溶质的质量分数为12.5%
(3)解:在20g 样品中加氢氧化钠溶液的质量与产生沉淀质量变化关系的示意图如下:
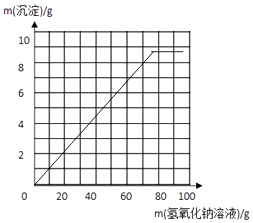
(4)氢氧化钡也会与杂质硫酸钠反应,导致测定结果偏大
【解析】解:(1)由表中1、3两次的数据可知,25g氢氧化钠溶液与硫酸镁反应能生成2.9g沉淀,因此50g氢氧化钠溶液能生成5.8g沉淀. 设样品中硫酸镁的质量分数为x.
MgSO4+2NaOH═ | Mg(OH)2↓+Na2SO4 |
120 | 58 |
20gx | 8.7g |
![]() =
= ![]()
x=90%(4)氢氧化钡也会与杂质硫酸钠反应,导致测定结果偏大,因此不能用氢氧化钡溶液代替氢氧化钠溶液来测定样品中硫酸镁的质量分数.
故填:(1)5.8;90%;(2)恰好完全反应时,溶液中溶质的质量分数为12.5%;(3) 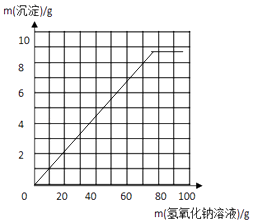 ;(4)氢氧化钡也会与杂质硫酸钠反应,导致测定结果偏大.
;(4)氢氧化钡也会与杂质硫酸钠反应,导致测定结果偏大.
【考点精析】认真审题,首先需要了解根据化学反应方程式的计算(各物质间质量比=系数×相对分子质量之比).

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案