题目内容
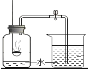
【题目】测定空气中氧气的含量,用下图所示的装置来完成。
(1)连接好实验仪器,在做实验之前应该检查装置的_____________.
(2)实验开始时观察到的现象是红磷燃烧产生:________________,当红磷熄灭并冷 却到室温后打开止水夹,看到的现象是__________,通过该实验得出氧气约占空气总体积的_____________.
(3)集气瓶中剩余的气体主要是______.上面的实验同时证明了该气体具有____、 _____化学性质。
(4)实验完毕,若进入集气瓶中水的体积不到总容积的1/5,你认为导致这一结果的原因可能是_________。(写两点)
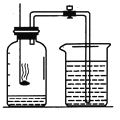
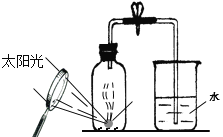
(5)某同学对实验进行反思后,提出了改进方法(如图所示 ),你认为改进后的优点是:____。
【答案】气密性 白烟 水进入集气瓶至第一刻度处 五分之一 氮气 不能燃烧 不支持燃烧 红磷不足(或装置漏气)(合理即可) 实验结果更准确,更环保
【解析】
(1)为防止装置漏气,连接好实验仪器,在做实验之前应该检查装置的气密性;
(2)实验开始时观察到的现象是红磷燃烧产生大量白烟,放出热量,当红磷熄灭并冷却到室温后打开止水夹,由于氧气被消耗,瓶内的气压降低,水进入集气瓶至第一刻度处,通过该实验得出氧气约占空气总体积的五分之一;
(3)集气瓶中剩余的气体主要是氮气,上面的实验同时证明了该气体具有化学性质是不能燃烧,不支持燃烧;
(4)实验完毕,若进入集气瓶中水的体积不到总容积的1/5,导致这一结果的原因可能是红磷不足,装置漏气,没有冷却至室温就打开止水夹等;
(5)改进后防止了燃烧匙伸入集气瓶中时导致的部分气体受热膨胀逸出,实验结果更准确,同时防止了反应生成的五氧化二磷扩散到空气中污染环境。

【题目】元素周期表是学习和研究化学的重要工具,下图是元素周期表的一部分
族 周期 | ⅠA | O | ||||||
1 | 1H 1.008 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 2He 4..003 |
2 | 3Li 6.941 | 4Be 9.01 | 5B 10.811 | 6C 12.010 | 7N 14.0067 | 8O 15.999 | 9F 18.998 | 10Ne 20.179 |
3 | 11Na 22.989 | 12Mg 24.305 | 13Al 26.981 | 14Si 28.085 | 15P 30.973 | 17Cl 35.452 | 18Ar 39.948 | |
(1)表中第14号元素名称是_____;空白处应该填上的原子序数和元素符号为____________
(2)查出磷元素的相对原子质量是___________ ;
(3)稀有气体的原子结构上有__________的特点。
(4)原子序数为11的元素与17的元素形成的物质名称为_____,由_____和____构成(填微粒符号)。
(5)硫元素的原子结构示意图为  ,该元素的原子核外有______个电子。
,该元素的原子核外有______个电子。
(6)2018年在新疆发现我国最大的铍(Be)矿。此元素原子的核电荷数为__;核外电子层数为____;
(7)同周期元素,从左到右,各元素原子随原子序数的增加,核外电子数依次是________。
(8)从Na、Mg原子结构示意图推知,金属Na、Mg化学性质不同的原因是____________
(9)X2﹣与Ne的核外电子排布相同,则X的元素符号是___,它处在元素周期表中第________周期;