题目内容
【题目】“微观与宏观相联系”是化学独特的思维方式,从宏观进入微观,探索物质变化实质.请结合图示完成下列问题:
(1)物质的三态变化,主要是由于( ).
A.微粒大小发生变化
B.微粒质量发生变化
C.变成了新微粒
D.微粒间的间隔发生改变
(2)醋酸(CH3COOH)是一种常见的酸,具有酸的通性例如:醋酸与氢氧化钠溶液反应生成醋酸钠和水,化学方程式为:CH3COOH+NaOH=CH3COONa+H2O.写出该反应的微观实质 , 醋酸与盐酸一样,能与活泼金属反应生成氢气,请写出醋酸与金属锌反应的化学方程式 .
(3)物质组成和结构决定其性质,性质决定其用途.过氧化氢是一种常见杀菌消毒剂,其原因是过氧化氢分子中含有一种叫做“过氧基’,(如图中虚线框标出的部分)的结构.据此推测如图1②﹣④的物质中,可用作杀菌消毒剂的是(填序号)
(4)胃酸过多须服用抗酸药.如表为两种抗酸药的有效成分及其构成微粒:
抗胃酸药 | 复方氢氧化镁片 | 铝碳酸镁片 |
有效成分 | Mg(OH)2 | AlMg(OH)3CO3 |
构成微粒 | Mg2+、OH﹣ | Al3+、Mg2+、OH﹣、CO32﹣ |
由于抗酸药有效成分不同,起抗酸作用(即消耗胃液中盐酸)的微粒也有差异.铝碳酸镁与盐酸反应为:AlMg(OH)3CO3+5HCl═MgCl2+AlCl3+4H2O+CO2↑.则铝碳酸镁起抗酸作用的微粒是、 (填微粒符号).
(5)一定条件下,甲和乙反应生成丙和丁(四 种物质均由分子构成),反应前后微观示意图如图2.下列说法正确的是(填选项)
A.反应前后共有4种原子
B.该反应有单质生成
C.反应前后元素化合价都不变
D.化学变化中分子和原子均可再分
E.该化学反应中,甲、丁两种分子的个数比是2:3.
【答案】
(1)D
(2)H++OH﹣=H2O;2CH3COOH+Zn=(CH3COO)2Zn+H2↑
(3)④
(4)OH﹣;CO32﹣
(5)B,D
【解析】解:(1)物质的三态变化,主要是由于微粒的间隔发生了变化,微粒的大小和质量没有发生变化,微粒本身没有变化.(2)由醋酸与氢氧化钠溶液反应生成醋酸钠和水的化学方程式为:CH3COOH+NaOH═CH3COONa+H2O可知,该反应的微观实质氢离子和氢氧根离子结合生成了水,即:H++OH﹣=H2O;醋酸与盐酸一样,能与活泼金属反应生成氢气,醋酸与金属锌反应生成醋酸锌和氢气,反应的化学方程式为:2CH3COOH+Zn=(CH3COO)2Zn+H2↑.(3)由“过氧基”的结构特点可知,可用作杀菌消毒剂的是④(4)铝碳酸镁的氢氧根离子能与氢离子结合生成了水,碳酸根离子能与氢离子结合生成了碳酸,碳酸易分解生成了二氧化碳和水,所以起抗酸作用的两种微粒分别是OH﹣、CO32﹣(5)根据反应前后分子变化的微观示意图和质量守恒定律可知,各物质反应的微粒个数关系如下图: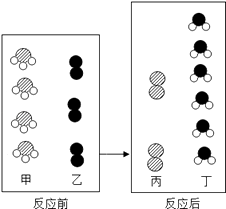
A、由图可知,反应前后一共有3种原子,故A错误;
B、由微粒的构成可知,该反应有单质生成,故B正确;
C、由微粒的变化可知,化学变化中分子可再分,但原子不可再分,故C错误;
D、由图可知,甲、丁两种分子的个数比是4:6=2:3,故D正确.
故答为:(1)D.(2)H++OH﹣=H2O;2CH3COOH+Zn=(CH3COO)2Zn+H2↑.(3)④.(4)OH﹣、CO32﹣ . (5)BD.
【考点精析】通过灵活运用单质和化合物的判别和分子的定义与分子的特性,掌握单质与化合物的区别:单质是由同一种元素组成的纯净物.只含有一种元素的物质,但必须是纯净物;化和物:是由不同种元素组成的纯净物;分子是保持物质化学性质最小的微粒;性质:体积小、质量小;不断运动;有间隙即可以解答此题.

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案