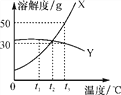
题目内容
【题目】盐酸是一种主要的工业用酸,下列关于盐酸的叙述中,错误的是( )
A.盐酸是氯化氢气体的水溶液
B.浓盐酸是黄色有刺激性气味的液体
C.人的胃液里含少量的盐酸,可以帮助消化
D.浓盐酸具有挥发性,在空气中会形成白雾
【答案】B
【解析】A、盐酸时氯化氢的水溶液,故A正确;
B、浓盐酸是无色液体,故B错误;
C、胃液中的盐酸具有帮助消化的功能,故C正确;
D、浓盐酸具有挥发性,挥发出的氯化氢气体与空气中的水蒸气结合能形成白雾,故D正确;
故选B.

【题目】化学物质之间的反应奥妙无穷。在一次化学探究活动中,同学们从不同角度对稀盐酸与氢氧化钠溶液的反应进行了探究,请你参与并填写以下空白。
(1)如何用实验验证稀盐酸与氢氧化钠溶液发生了反应。
第一组同学设计了实验方案一:
实验步骤 | 实验现象 | 结论 |
先用pH试纸测定稀盐酸的pH,再逐渐滴加氢氧化钠溶液,并不断振荡,同时测定混合液的pH | pH逐渐________(填“变大”或“变小”),最后pH≥7 | 稀盐酸与氢氧化钠溶液发生了反应 |
①请你分析:上述方案中为什么强调只有测得的pH≥7才能证明反应了?_____________________________________________。
②写出稀盐酸与氢氧化钠溶液反应的化学方程式________________________________。
(2)第二组同学在做完稀盐酸与氢氧化钠溶液反应的实验后,为探究稀盐酸与氢氧化钠溶液是否恰好完全反应,设计了实验方案二:
实验步骤 | 实验现象 | 结论 |
取少量上述反应后的溶液于试管中,滴加酚酞溶液 | 若______________ | 氢氧化钠溶液过量 |
若无明显现象 | 稀盐酸与氢氧化钠溶液恰好完全反应 |
此时有同学提出方案二不能证明稀盐酸与氢氧化钠溶液恰好完全反应,其原因是________________________________,为此,还需要选择________________或________,再进行实验即可。