��Ŀ����
Ԫ�ؼ��仯����֪ʶ�ǻ�ѧ�о���ѧϰ����Ҫ���ݡ�
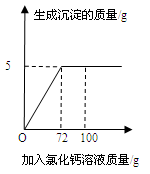
��1���Ȼ��ơ��Ȼ��ƺ��Ȼ�þ�ж�������Ԫ�أ���ͼ������Ԫ�����ڱ��е������Ϣ������˵������ȷ���� �����ţ���

��������飬��ˮ���е�ij��������ζ�����ɸ����ʵ����� �������ӷ��ţ���
̼�������ڱ��Ƹ���ը����ʱ���������ݼ����û�ѧ����ʽ������ԭ��
��4������һ����ɫ��ĩ�����к���CuSO4��BaCl2��NaOH��Na2CO3�е�һ�ֻ��֡�ij��ѧС��Ϊȷ����ɫ��ĩ�ijɷ֣�����������ʵ�飺��I��ȡһ������ɫ��ĩ����������ˮ�����õ���ɫ����Һ������ȡ������I������Һ�������������ᣬ�����ݲ���������ʾ��BaCO3������ˮ��Na2CO3��ˮ��Һ�ʼ��ԣ�
�ٸð�ɫ��ĩ�п϶�����ʲô���ʣ����ܺ���ʲô���ʣ�
��Ϊȷ�����ܺ��е������Ƿ���ڣ�����Ҫ����һ����ʵ����֤����д����Ҫ��ʵ�鲽�衣
ʳ�ô����г������������Ȼ��ơ���ȡijʳ�ô�����Ʒ20g������һ����ϡ����ǡ����ȫ��Ӧ��ͬʱ������6.6g���塣�Լ����ʳ�ô�����̼���Ƶ�������������д��������̣���
��1���Ȼ��ơ��Ȼ��ƺ��Ȼ�þ�ж�������Ԫ�أ���ͼ������Ԫ�����ڱ��е������Ϣ������˵������ȷ���� �����ţ���


| A����Ԫ�����ڷǽ���Ԫ�� |
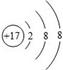
| B����ԭ�Ӻ���������Ϊ17 |
| C����Ԫ�ص�ԭ���γ������Ӻ����ӽṹʾ��ͼΪ |
| D����Ԫ�ص����ԭ������Ϊ35.45g |
̼�������ڱ��Ƹ���ը����ʱ���������ݼ����û�ѧ����ʽ������ԭ��
��4������һ����ɫ��ĩ�����к���CuSO4��BaCl2��NaOH��Na2CO3�е�һ�ֻ��֡�ij��ѧС��Ϊȷ����ɫ��ĩ�ijɷ֣�����������ʵ�飺��I��ȡһ������ɫ��ĩ����������ˮ�����õ���ɫ����Һ������ȡ������I������Һ�������������ᣬ�����ݲ���������ʾ��BaCO3������ˮ��Na2CO3��ˮ��Һ�ʼ��ԣ�
�ٸð�ɫ��ĩ�п϶�����ʲô���ʣ����ܺ���ʲô���ʣ�
��Ϊȷ�����ܺ��е������Ƿ���ڣ�����Ҫ����һ����ʵ����֤����д����Ҫ��ʵ�鲽�衣
ʳ�ô����г������������Ȼ��ơ���ȡijʳ�ô�����Ʒ20g������һ����ϡ����ǡ����ȫ��Ӧ��ͬʱ������6.6g���塣�Լ����ʳ�ô�����̼���Ƶ�������������д��������̣���
(1) D (2) Na+��Cl-- (3) 2NaHCO3��Na2CO3 + H2O + CO2��
(4) �ٿ϶�����Na2CO3�����ܺ���NaOH
�� ȡ������I������Һ����������BaCl2��Һ����CaCl2��Һ�������ã�ȡ�ϲ���Һ�μӷ�̪��Һ������pH��ֽ�ⶨpH��
��5��79.5%
(4) �ٿ϶�����Na2CO3�����ܺ���NaOH
�� ȡ������I������Һ����������BaCl2��Һ����CaCl2��Һ�������ã�ȡ�ϲ���Һ�μӷ�̪��Һ������pH��ֽ�ⶨpH��
��5��79.5%
�����������1��A����Ԫ�����Ƶ�ƫ�Բ����ǡ�����ͷ�����ڷǽ���Ԫ�أ���ȷ��B����ԭ�Ӻ���������Ϊ17����ȷ��C����Ԫ�ص�ԭ������������Ϊ7���������õ�1�����ӣ��γ������ӣ���ȷ��D����Ԫ�ص����ԭ������Ϊ35.45����λ����g����ȷ
��2����ˮ���е�ij��������ζ�������ں�Һ�к����Ȼ��ƣ��������ӹ��ɵģ����ɸ����ʵ����ǣ�Na+��Cl--
��3��̼�������ڱ��Ƹ���ը����ʱ���������ݼ�������Ϊ̼�����������ֽ⣬�����Ļ�ѧ����ʽ�ǣ�2NaHCO3��Na2CO3 + H2O + CO2��
��4������һ��ʵ���ƶ��⣬Ӧ������סʵ��Ĺ��̣�ץסʵ������е�������з�����ʵ�飺��I��ȡһ������ɫ��ĩ����������ˮ�����õ���ɫ����Һ��˵��һ�㲻��CuSO4����ΪCuSO4��ˮ��Һ����ɫ��ͬʱBaCl2��Na2CO3���ܹ��棬��Ϊ���γɰ�ɫ��������ʵ����û�����������ȡ������I������Һ�������������ᣬ�����ݲ�����˵��һ����Na2CO3����һ������BaCl2
�ٸð�ɫ��ĩ�п϶����к���Na2CO3�����ܺ���NaOH
��Ҫȷ��NaOH�Ƿ���ڣ������ʵ�鲽�裺ȡ������I������Һ����������BaCl2��Һ����CaCl2��Һ�������ã�ȡ�ϲ���Һ�μӷ�̪��Һ������pH��ֽ�ⶨpH��������ֱ��������NaOH�Ƿ���ڣ���ΪNa2CO3��ˮ��ҺҲ�ʼ���
��5�����ݷ�Ӧ��Na2CO3+2HCl==2NaCl+H2O+CO2����Na2CO3��CO2������ϵ�������Na2CO3���������������ʳ�ô�����̼���Ƶ���������
�⣺��Na2CO3������Ϊx
Na2CO3+2HCl==2NaCl+H2O+CO2��
106 44
x 6.6g
106/44="==" x/ 6.6g x="=15.9" g
̼���Ƶ���������Ϊ��15.9 / 20��100%===79.5%

��ϰ��ϵ�д�
�����Ŀ