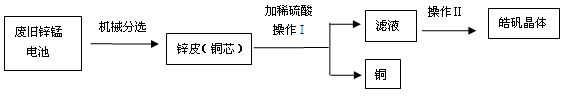
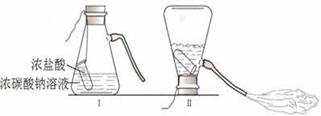
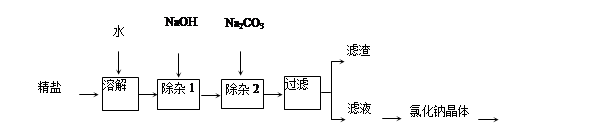题目内容
某K2CO3样品,可能含有Na2CO3、MgCO3、NaCl中的几种杂质.取该样品6.9g,加入50g稀盐酸中,恰好完全反应得到无色溶液,同时产生2.2g气体.下列判断正确的是( )
| A.样品中一定没有MgCO3 |
| B.NaCl不与盐酸反应,说明样品中一定没有NaCl |
| C.所加稀盐酸中溶质的质量分数为7.3% |
| D.Na2CO3和MgCO3都能和稀盐酸反应生成气体,说明样品中一定有Na2CO3和MgCO3 |
C
试题分析:根据化学方程式K2CO3+2HCl==2KCl+H2O+CO2↑
73 44
6.9g 3.65g 2.2
的数据关系可知,因为碳酸钠和碳酸镁的相对分子质量均小于碳酸钾的138,混有其中的一种或两种时生成的二氧化碳的质量要大于2.2g,故说明样品中一定含有氯化钠,可能混有碳酸钠和碳酸镁中的一种和两种,所以排除ABD,
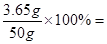 7.3%,故答案选择C
7.3%,故答案选择C
练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目