题目内容
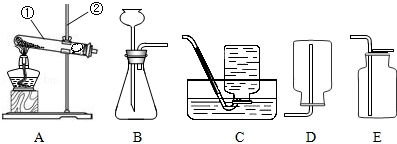
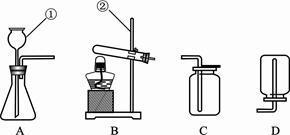
根据如图实验装置回答问题.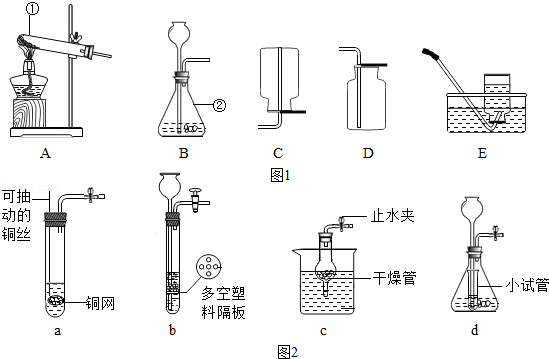
(1)写出图1中标有序号仪器的名称:① ;② .
(2)选用装置B制氧气时发生反应的化学方程式为 .
(3)实验室制取二氧化碳所选用的收集装置为 (填装置代号,下同).
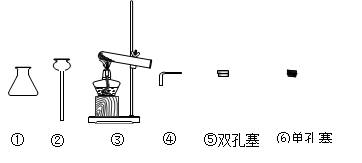
(4)图2气体的发生装置中,在制二氧化碳时能起到“控制反应的发生或停止”效果的是 .
(1)试管;锥形瓶;
(2)2H2O2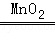 2H2O+O2↑;
2H2O+O2↑;
(3)D;
(4)ac.
解析试题分析:(1)标有序号的仪器名称:①试管,②锥形瓶;
(2)装置B适用于固体和液体反应不需加热制取气体,实验室用二氧化锰催化过氧化氢溶液制取氧气不需加热可用此发生装置,过氧化氢在二氧化锰催化作用下分解生成水和氧气,方程式是:2H2O2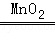 2H2O+O2↑;
2H2O+O2↑;
(3)由于二氧化碳能溶于水,密度比空气大,所以可用向上排空气法进行实践;
(4)a装置中大理石放于铜网上,可通过上下抽动铜网随时控制反应发生和停止;b装置长颈漏斗下端在液面以上,会造成气体从长颈漏斗逸出,且无法使反应终止;c装置打开止水夹,固体和液体接触反应,关闭止水夹,干燥管内气压增大,将液体压出干燥管,固液分离,反应终止;d装置中关闭止水夹无法使小试管内液体压入长颈漏斗,故反应无法终止,符合题意的是ac;
考点:常用气体的发生装置和收集装置与选取方法;实验室制取氧气的反应原理;二氧化碳的实验室制法;书写化学方程式、文字表达式、电离方程式.
点评:解答本题首先要掌握实验室制取氧气的常用方法,收集装置的选择依据,了解常用仪器名称和用途,其次能据装置特点分析其优越性,考查了学生分析解决问题的能力.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目








 NaCl+N2↑+2H2O
NaCl+N2↑+2H2O