题目内容
某同学将6克镁条加入到70毫升的稀硫酸中,恰好完全反应,反应后所得溶液的质量为100克,试计算:(1)该反应共生成H2的质量;
(2)这种稀H2SO4溶液的密度;
(3)反应后所得溶液中溶质的质量分数.
【答案】分析:根据镁与硫酸反应的化学方程式,由6g镁的质量计算恰好完全反应时放出氢气的质量、参加反应的硫酸的质量、及反应生成硫酸镁的质量,然后分别利用密度的计算公式、溶液中溶质质量分数的计算公式,求出硫酸溶液的密度和反应后所得溶液中溶质的质量分数.
解答:解:设硫酸溶液中溶质的质量为x,生成氢气的质量为y
Mg+H2SO4=MgSO4+H2↑
24 98 2
6g x y
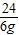 =
=
x=24.5g
 =
=
y=0.5g
因为二者恰好完全反应,根据质量守恒定律,硫酸镁的质量为:24.5g+6g-0.5g=30g
硫酸溶液的密度= ×100%=0.35g/mL
×100%=0.35g/mL
硫酸镁溶液的溶质质量分数= ×100%=30%
×100%=30%
答:(1)生成氢气的质量为0.5g;
(2)硫酸溶液的密度是0.35g/mL;
(3)反应后所得溶液中溶质的质量分数为30%.
点评:本题考查了根据化学方程式的计算,完成此题,可以依据题干提供的信息结合溶质质量分数公式和密度的计算公式进行解答.
解答:解:设硫酸溶液中溶质的质量为x,生成氢气的质量为y
Mg+H2SO4=MgSO4+H2↑
24 98 2
6g x y
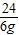 =
=
x=24.5g
 =
=
y=0.5g
因为二者恰好完全反应,根据质量守恒定律,硫酸镁的质量为:24.5g+6g-0.5g=30g
硫酸溶液的密度=
 ×100%=0.35g/mL
×100%=0.35g/mL硫酸镁溶液的溶质质量分数=
 ×100%=30%
×100%=30%答:(1)生成氢气的质量为0.5g;
(2)硫酸溶液的密度是0.35g/mL;
(3)反应后所得溶液中溶质的质量分数为30%.
点评:本题考查了根据化学方程式的计算,完成此题,可以依据题干提供的信息结合溶质质量分数公式和密度的计算公式进行解答.

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目