题目内容
【题目】元素周期表是学习和研究化学的重要工具,如表是元素周期表的一部分,回答下列问题:
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | 0 | |
2 | 3 锂 6.941 | 5 硼 10.81 | 6 碳 12.01 | 7 氮 14.01 | 8 氧 16.00 | 9 氟 19.00 | 10 氖 20.18 | ||
3 | 11 钠 22.99 | 12 镁 24.31 | 13 铝 26.98 | 14 硅 28.09 | 15 磷 30.97 | 16 硫 32.06 | 17 氯 35.45 | 18 氩 39.95 | |
4 | 19 钾 39.10 | 20 40.08 | …… | 31 镓 69.72 | 32 锗 72.64 | 33 砷 74.92 | 34 硒 78.96 | 35 溴 79.90 | 36 氪 83.80 |
(1)若锂元素在周期表中的位置可表示为“第二周期1A族”,则地壳中含量最高的金属元素在周期表中的位置可表示为________________;
(2)位于第四周期IVA族元素的单质是最早使用的半导体材料,该元素的名称是________,其原子核内有________个质子:
(3)某粒子的结构意图如图所示,若该粒子为某稀有气体元素的原子,则该元素的单质的相对分子质量为________(取整数);若该粒子为-1价离子,则离子符号为________。
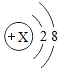
【答案】第3周期IIIA族 锗 32 20 ![]()
【解析】
解:(1)锂原子有2个电子层,最外层电子数为1,若锂元素在周期表中的位置可表示为“第2周期IA族”,地壳中含量最高的金属元素是铝,原子有3个电子层,最外层电子数为3,在周期表中的位置可表示为第3周期IIIA族;
(2)位于第4周期ⅣA族元素的元素是锗,带“钅”字旁,属于金属元素;原子序数为32,所以质子数为32;
(3)若该粒子为某稀有气体元素的原子,核内质子数=核外电子数,则该原子为10号元素氖元素原子,由于稀有气体直接由原子构成,则该元素的单质的相对分子质量为20;若该粒子为-1价阴离子,则x=2+8-1=7,则为氟离子,符号为:![]() 。
。

 小题狂做系列答案
小题狂做系列答案【题目】在研究金属化学性质的实验中,下列操作不能达到实验目的是![]()
![]()
选项 | 实验目的 | 实验操作 |
A | 证明不同金属与酸反应的剧烈程度不同 | 将铜和银分别放入稀盐酸中 |
B | 研究金属是否都能与盐酸反应 | 将镁、锌、铜片分别放入稀盐酸中 |
C | 证明铜的活动性比银强 | 将铜放入硝酸银溶液中 |
D | 比较锌和铜的金属活动性 | 将锌和铜分别放入稀硫酸中 |
A. AB. BC. CD. D