题目内容
3.0g某物质完全燃烧后生成4.4gCO2和1.8g水。则对该物质相关判断正确的是
| A.该物质只含碳、氢元素 |
| B.该物质一定含有碳、氢元素,可能含有氧元素 |
| C.该物质一定由碳、氢、氧三种元素组成 |
| D.该物质分子中碳原子和氢原子的个数比为1:2 |
CD
解析试题分析:根据质量守恒定律,反应前后元素的种类和质量不变。反应生成物中有碳元素、氢元素与氧元素,所以反应物中也必须有这三种元素,反应物氧气中一定有氧元素,所以该物质中一定含碳元素与氢元素,可能含氧元素。并且通过计算,我们可以求出碳元素与氢元素的质量分别是多少,如果两者总和比该物质的质量3.0克小,则该物质中一定还含氧元素,如果两者总和与该物质的质量3.0克相等,则该物质中只含碳氢元素,不含氧元素。据此分析,我们作出如下计算:该物质中碳元素质量为:4.4g× ×100%=1.2g。该物质中含氢元素质量为:1.8g×
×100%=1.2g。该物质中含氢元素质量为:1.8g×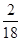 ×100%=0.2g。碳元素与氢元素质量总和为1.2g+0.2g=1.4g,比该物质3.0克小,所以判断该物质中含有氧元素,且氧元素质量为3.0-1.4=1.6g。故A、B、C中选C。该物质分子中碳原子和氢原子的个数比为
×100%=0.2g。碳元素与氢元素质量总和为1.2g+0.2g=1.4g,比该物质3.0克小,所以判断该物质中含有氧元素,且氧元素质量为3.0-1.4=1.6g。故A、B、C中选C。该物质分子中碳原子和氢原子的个数比为 ∶
∶ =1∶2。D正确。
=1∶2。D正确。
考点:质量守恒定律

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案2012年2月江苏镇江自来水出现异味,引发当地居民抢购瓶装饮用水现象。经初步查明,韩国籍船舶“格洛里亚”号货轮水下排放管道排出的苯酚(化学式C6H6O)是污染水源的主要原因。下列关于苯酚的说法不正确的是( )
| A.苯酚的相对分子质量为50 |
| B.苯酚由碳、氢、氧三种元素组成 |
| C.苯酚中碳、氢、氧三种元素的质量比为36:3:8 |
| D.每个苯酚分子含有13个原子 |
下列化学用语既能表示一种元素,又能表示一个原子,还能表示一种物质的是( )
| A.O | B.CO | C.N2 | D.Zn |
元素周期表是学习化学的重要工具。下表是元素周期表的部分,我们对它进行研究:
| 第一周期 | 1 H | | 2 He | |||||
| 第二周期 | 3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne |
| 第三周期 | 11 Na | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar |
(1)第16号元素属于 元素(填“金属”或“非金属”),它在化学反应中容易 (填“得”或“失”)电子;
(2)元素的化学性质与原子结构中的 数关系密切;
(3)在同一纵行中,各元素的原子结构的规律有
下列应用相应的原理(用化学方程式表示)及基本反应类型均正确的是( )
| A.用稀盐酸除铁锈 Fe2O3+6HCl═2FeCl2+3H2O复分解反应 |
| B.用纯碱制烧碱 Ca(OH)2+Na2CO3═CaCO3↓+2NaOH复分解反应 |
| C.用电解水的方法测定水的组成 2H2O═2H2↑+O2↑分解反应 |
D.铁丝在氧气中燃烧 3Fe+2O2 Fe3O4氧化反应 Fe3O4氧化反应 |
我国化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”。铈(Ce)是一种常见的稀土元素,下列关于铈的说法错误的是
| A.原子序数是58 | B.铈元素是非金属元素 |
| C.质子数为58 | D.相对原子质量是140.1 |
在一个密闭容器中,有甲、乙、丙、丁四种物质在一定条件下充分反应后,测得反应前后各物质的质量如下表
下列说法错误的是
| A.该反应是分解反应 | B.甲可能是该反应的催化剂 |
| C.乙、丙变化的质量比为9:8 | D.反应后甲的质量为0g |
生活中我们常用消毒剂有:过氧乙酸(C2H4O3)、次氯酸钠(NaClO),过氧化氢(H2O2)等,下列关于这些消毒剂的叙述中,正确的是
| A.上述三种物质都是氧化物 |
| B.过氧化氢(H2O2)分子中不含氧分子 |
| C.次氯酸钠(NaClO)中氯元素的化合价为+1价 |
| D.过氧乙酸(C2H4O3)中碳、氢、氧三种元素的质量比为2:4:3 |