题目内容
自然界的矿物中有一种重晶石矿,它的主要成分是BaSO4,它不溶于任何酸、碱和水,纯净的硫酸钡可供医疗等方面应用。某同学用重晶石和焦炭为原料,制取纯净硫酸钡,部分流程如下(设矿物中杂质不与焦炭反应,也不溶于水):
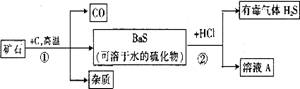
(1)步骤①中,哪些元素的化合价升高,哪些元素的化合价降低? ;
(2)步骤②中溶液A中溶质的化学式: ;
(3)写出利用溶液A中的溶质为主要原料制取BaSO4的化学方程式: ;
(4)步骤②产生有毒气体H2S,应加以改进,为使实验既不产生H2S又能获得纯净BaSO4,请你提出改进意见 ;有关反应的化学方程式是 。
(1)C,S (2)BaCl2
(3)BaCl2+Na2SO4====BaSO4↓+2NaCl
(4)可在步骤(2)中加入Na2SO4,然后过滤,洗涤后得到纯净的BaSO4固体BaS+Na2SO4====BaSO4↓+Na2S

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目




