题目内容
【题目】工业上利用软锰矿(主要成分MnO2)制备高锰酸钾的流程如图所示。回答下列问题:
(信息提示:MnO2不溶于水,含钾化合物均可溶于水)
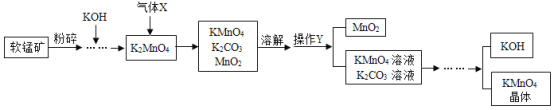
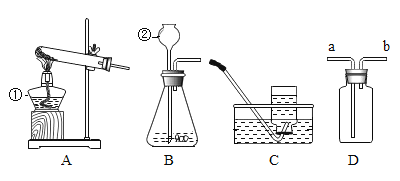
(1)将软锰矿粉碎的目的是_____。
(2)流程中通入的气体X是_____(填标号)。
A N2 B CO2 C H2
(3)操作Y的名称是_____。
(4)上述流程中可循环利用的物质有_____。
【答案】增大反应物间接触面积,加快反应速率 B 过滤 KOH、MnO2或MnO2、KOH
【解析】
(1)将软锰矿粉碎的目的是增大反应物之间的接触面积,使反应速率更快;
故填:增大反应物间接触面积,加快反应速率。
(2)根据流程中,K2MnO4中通入X得到KMnO4、K2CO3、MnO2,根据化学变化中,元素种类不发生改变,通入的气体X应该是CO2;
故选:B。
(3)通过操作Y得到不溶于水的MnO2固体和KMnO4溶液、K2CO3溶液,能得到固体和液体的操作是过滤;
故填:过滤。
(4)根据流程分析可知:在开始的反应物和最终的生成物中都含有MnO2和KOH,所以MnO2和KOH能循环使用;
故填:MnO2和KOH。

【题目】(实验回顾)18世纪末,英国科学家普利斯特里和卡文迪许把“易燃空气”与空气或氧气混合后盛在干燥、洁净的玻璃瓶中,当用电火花点火时,发出震耳的爆鸣声,且玻璃瓶内壁上出现了液滴。一年之后,拉瓦锡重复了他们的实验,并做了一个相反的实验:让水蒸气通过一根烧红的枪管,得到了“易燃空气”。这里的“易燃空气”是指_____,拉瓦锡通过上述实验得到的结论是_____。
(实验重现)某化学兴趣小组的同学为了体验科学家们探究的过程,在创新的基础上,在实验室中重做了上述两个实验,做法如下:
实验1:水的通电分解实验,如图1所示,接通电源,看到了两电极上开始产生气泡,一段时间后两玻璃管内的现象是_____。

实验2:“易燃空气”与氧气混合后的点燃实验。实验室现有过氧化氢溶液、氯酸钾、二氧化锰、稀硫酸、锌粒和图2所示的常用仪器。
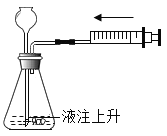
(1)利用上述仪器和药品制取较多量的“易燃空气”,且可以随时补充液体,你选择的仪器有_____(填序号),药品是_____,反应原理用化学方程式表示为_____。
(2)该兴趣小组的同学把“易燃空气”与氧气按一定比例混合后盛在干燥、洁净的玻璃瓶中,用电火花点火,顺利完成上述实验。
(3)该兴趣小组的同学决定利用制得的“易燃空气”和空气继续进行探究,他们取7支试管,依次盛水90%(体积分数)、80%、70%……再用排水集气法收集“易燃空气”,而后分别把试管口移近酒精灯的火焰,实验结果如下表所示:
序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
“易燃空气”体积分数(%) | 90 | 80 | 70 | 50 | 20 | 10 | 5 |
空气体积分数(%) | 10 | 20 | 30 | 50 | 80 | 90 | 95 |
点燃现象 | 安静燃烧 | 安静燃烧 | 弱的爆鸣声 | 强的爆鸣声 | 强的爆鸣声 | 弱的爆鸣声 | 不燃烧不爆鸣 |
分析表中信息可知,在混合气体爆炸范围内,“易燃空气”的体积分数约为_____;所以我们在点燃“易燃空气”之前必须要_____。