题目内容
【题目】Ⅰ、质量守恒定律的发现对化学的发展做出了重要贡献.
(1)通过称量下列各组试剂在密闭容器内混合前后的总质量,能验证质量守恒定律的是(填标号),有关反应的化学方程式为.
A.蔗糖和水 B.氯化钠溶液和硝酸钾溶液 C.铁和氯化铜溶液
(2)在氧气中点燃红磷的实验过程,固体变化如图6所示.
①燃烧条件分析,固体质量在t1前没有发生变化的原因是.
②该反应的化学方程式为.
③参加反应的氧气质量为g.
(3)某反应的微观示意图如图7所示: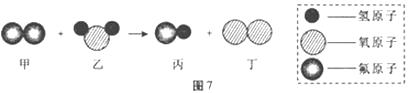
①该反应所属的基本反应类型为.
②参加反应的甲物质和生成的丙物质分子数目比为.
(4)Ⅱ、甲和乙两种固态物质的饱和溶液中溶质质量分数与温度的关系如图8所示.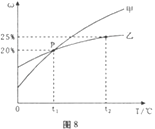
甲和乙两种物质的溶解度随温度的升高而(填“增大”或“减小”).
(5)下列对P点的含义叙述正确的是(填标号).
A.t1℃时,甲和乙两种物质的溶解度相等
B.t1℃时,甲和乙两种物质溶液的溶质质量分数相等
C.t1℃时,甲和乙两种物质的饱和溶液中溶质的质量相等
(6)25g乙物质完全溶于100g水中所需的最低温度是℃.
(7)t2℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是(填“甲”或“乙”)物质饱和溶液.
【答案】
(1)C,Fe+CuCl2=FeCl2+Cu
(2)温度未达到红磷着火点,4P+5O2 ![]() 2P2O5,8
2P2O5,8
(3)置换反应,1:2
(4)增大
(5)A
(6)t1
(7)乙
【解析】Ⅰ、(1)A、蔗糖和水是溶解过程,是物理变化,不能直接用于验证质量守恒定律;
B、氯化钠溶液和硝酸钾溶液,相互之间不反应,不能直接用于验证质量守恒定律;
C、铁和氯化铜溶液,铁比铜活泼,可以将铜置换出来,是化学变化,能直接用于验证质量守恒定律;
(2)①从燃烧条件分析,固体质量在t1前没有发生变化的原因为温度未达到红磷的着火点;②红磷在氧气中燃烧生成五氧化二磷,反应的化学方程式为:4P+5O2 ![]() 2P2O5;③从图示看出,6.2g表示反应前固体的质量,就是红磷的质量,14.2g表示反应后固体的质量,是五氧化二磷的质量,则14.2g-6.2g=8g就表示参加反应的氧气的质量;
2P2O5;③从图示看出,6.2g表示反应前固体的质量,就是红磷的质量,14.2g表示反应后固体的质量,是五氧化二磷的质量,则14.2g-6.2g=8g就表示参加反应的氧气的质量;
(3)由物质的微观构成可知,该反应的化学方程式为:2F2+H2O=4HF+O2;①该反应所属的基本类型为置换反应;②参加反应的甲物质和生成的丙物质分子数目比为2:4=1:2;
Ⅱ、(4)通过分析溶解度曲线可知,甲和乙两种物质的溶解度随温度升高而增大;
(5)A、t1℃时,甲和乙两种物质的溶解度相等,故A正确;
B、t1℃时,甲和乙两种物质溶液的状态不能确定,所以溶质质量分数不能确定,故B错误;
C、t1℃时,甲和乙两种物质的饱和溶液的质量不能确定,所以溶质的质量不一定相等,故C错误;
(6)t1℃时,甲、乙物质的溶质质量分数为20%,所以溶解度是25g,25g乙物质完全溶于100g水中所需的最低温度是t1℃;
(7)t2℃时,甲物质的溶解度大于乙物质,所以甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是乙物质.
所以答案是:Ⅰ、(1)C;Fe+CuCl2=FeCl2+Cu;(2)温度未达到红磷着火点;4P+5O2![]() 2P2O5;8;(3)置换反应;1:2;Ⅱ、(4)增大;(5)A;(6)t1;(7)乙;
2P2O5;8;(3)置换反应;1:2;Ⅱ、(4)增大;(5)A;(6)t1;(7)乙;
【考点精析】根据题目的已知条件,利用溶质的质量分数、溶解性和溶解度的关系和质量守恒定律及其应用的相关知识可以得到问题的答案,需要掌握溶质质量分数 =溶质质量/溶液质量*100% ;溶解度=溶质质量/溶剂质量*100g (必须选取饱和溶液);溶液质量=溶质质量(克)+溶剂质量(克) ;对于饱和溶液,溶液质量分数w = S/(S+100);所以溶解度S = 100/(1/w-1);①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏.
