题目内容
有核电荷数都小于18的A、B、C、D四种元素,A与B能形成AB型化合物,其中A元素的质量分数为60%,且A元素的原子核内质子数等于中子数;B原子最外层电子数是次外层(倒数第二层)电子数的3倍;C元素的原子核内无中子;D元素的原子核内有10个质子.根据以上叙述,写出四种元素的元素名称、元素符号,并画出原子结构示意图.
A: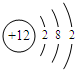
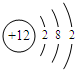 .
.
B: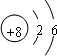
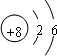 .
.
C: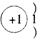
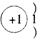 .
.
D: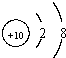
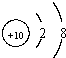 .
.
A:
镁
镁
Mg
Mg
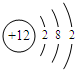
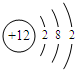
B:
氧
氧
O
O
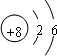
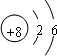
C:
氢
氢
H
H
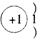
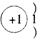
D:
氖
氖
Ne
Ne
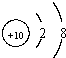
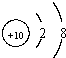
分析:根据B原子最外层电子数是次外层(倒数第二层)电子数的3倍,说明B原子有两个电子层,最外层电子数是次外层电子数的3倍,应为O元素;A能够和氧元素形成AB型的化合物,且A元素的质量分数为60%,根据公式计算可知A的相对原子质量为24,且A元素的原子核内质子数等于中子数,因此A的质子数为12,因此是镁;C元素原子内无中子”则C为氢元素;D元素的原子核内有10个质子,因此D是氖元素,据此完成相关的问题.
解答:解:B原子最外层电子数是次外层(倒数第二层)电子数的3倍,说明B原子有两个电子层,最外层电子数是次外层电子数的3倍,应为O元素,原子核外的电子排布是2、6;A能够和氧元素形成AB型的化合物,且A元素的质量分数为60%,根据公式
×100%=60%,计算可知A的相对原子质量为24,且A元素的原子核内质子数等于中子数,因此A的质子数为12,因此是镁,原子核外的电子排布是2、8、2;C元素原子内无中子”则C为氢元素,原子核外的电子排布是1;D元素的原子核内有10个质子,因此D是氖元素,原子核外的电子排布是2、8;
故答案为:A、镁、Mg、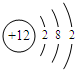 ;
;
B、氧、O、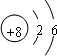 ;
;
C、氢、H、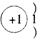 ;
;
D、氖、Ne、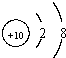 .
.
| A的相对原子质量 |
| A的相对原子质量+16 |
故答案为:A、镁、Mg、
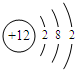 ;
;B、氧、O、
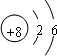 ;
;C、氢、H、
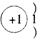 ;
;D、氖、Ne、
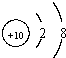 .
.点评:本题主要考查了化学式的意义及其书写,了解原子结构示意图和离子结构示意图,掌握相对原子质量的概念及其计算和元素的质量分数的计算.

练习册系列答案
 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目