题目内容
为研究某一镁铝合金的成分,进行甲、乙、丙三组实验.三组各取30mL同浓度的盐酸溶液,加入该种镁铝合金粉末.每组实验加入合金质量和产生气体质量的有关数据如下:| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(g) | 0.255 | 0.385 | 0.495 |
| 气体质量(g) | 0.025 | 0.03 | 0.03 |
(1)甲组实验中,盐酸______(填“过量““适量”或“不足量”),乙组实验中,盐酸______(填“过量”“适量”或“不足量”).
(2)合金中镁、铝的质量比______.
【答案】分析:(1)由甲乙中的数据可知,合金的质量增大的倍数为:0.385g÷0.255g=1.510倍,气体质量增大的倍数为:0.03g÷0.025g=1.2倍,由此可知,甲中盐酸过量.由乙丙中的数据可知,随着合金质量的增加,生成气体的质量不变,说明乙中盐酸不足量.
(2)根据甲中数据可以求出合金中镁、铝的质量.
解答:解:(1)合金的质量增大的倍数为:0.385g÷0.255g=1.510倍,气体质量增大的倍数为:0.03g÷0.025g=1.2倍,由此可知,甲中盐酸过量.故填:过量.
随着合金质量的增加,生成气体的质量不变,说明乙中盐酸不足量.故填:不足量.
(2)解设铝的质量为X,生成氢气的质量为Y.
Mg+2HCl=MgCl2+H2↑,2Al+6HCl═2AlCl3+3H2↑.
24 2 54 6
0.255g-X 0.025g-Y X Y
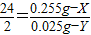 ①
①
 ②
②
由①②可得:X=0.135g,Y=0.015g,则镁的质量为:0.255g-0.135g=0.12g,则 合金中镁、铝的质量比为:0.12g:0.135g=8:9.
故填:8:9.
点评:本题主要考查计算方面的知识,进行计算时要把化学方程式和相关量一一对应起来进行.
(2)根据甲中数据可以求出合金中镁、铝的质量.
解答:解:(1)合金的质量增大的倍数为:0.385g÷0.255g=1.510倍,气体质量增大的倍数为:0.03g÷0.025g=1.2倍,由此可知,甲中盐酸过量.故填:过量.
随着合金质量的增加,生成气体的质量不变,说明乙中盐酸不足量.故填:不足量.
(2)解设铝的质量为X,生成氢气的质量为Y.
Mg+2HCl=MgCl2+H2↑,2Al+6HCl═2AlCl3+3H2↑.
24 2 54 6
0.255g-X 0.025g-Y X Y
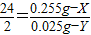 ①
① ②
②由①②可得:X=0.135g,Y=0.015g,则镁的质量为:0.255g-0.135g=0.12g,则 合金中镁、铝的质量比为:0.12g:0.135g=8:9.
故填:8:9.
点评:本题主要考查计算方面的知识,进行计算时要把化学方程式和相关量一一对应起来进行.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
为研究某一镁铝合金的成分,进行甲、乙、丙三组实验.三组各取30mL同浓度的盐酸溶液,加入该种镁铝合金粉末.每组实验加入合金质量和产生气体质量的有关数据如下:
请根据表中数据判断和计算:
(1)甲组实验中,盐酸 (填“过量““适量”或“不足量”),乙组实验中,盐酸 (填“过量”“适量”或“不足量”).
(2)合金中镁、铝的质量比 .
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(g) | 0.255 | 0.385 | 0.495 |
| 气体质量(g) | 0.025 | 0.03 | 0.03 |
(1)甲组实验中,盐酸
(2)合金中镁、铝的质量比
为研究某一镁铝合金的成分,进行甲、乙、丙三组实验.三组各取30mL同浓度的盐酸溶液,加入该种镁铝合金粉末.每组实验加入合金质量和产生气体质量的有关数据如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(g) | 0.255 | 0.385 | 0.495 |
| 气体质量(g) | 0.025 | 0.03 | 0.03 |
(1)甲组实验中,盐酸______(填“过量““适量”或“不足量”),乙组实验中,盐酸______(填“过量”“适量”或“不足量”).
(2)合金中镁、铝的质量比______.
为研究某一镁铝合金的成分,进行甲、乙、丙三组实验.三组各取30mL同浓度的盐酸溶液,加入该种镁铝合金粉末.每组实验加入合金质量和产生气体质量的有关数据如下:
请根据表中数据判断和计算:
(1)甲组实验中,盐酸______(填“过量““适量”或“不足量”),乙组实验中,盐酸______(填“过量”“适量”或“不足量”).
(2)合金中镁、铝的质量比______.
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(g) | 0.255 | 0.385 | 0.495 |
| 气体质量(g) | 0.025 | 0.03 | 0.03 |
(1)甲组实验中,盐酸______(填“过量““适量”或“不足量”),乙组实验中,盐酸______(填“过量”“适量”或“不足量”).
(2)合金中镁、铝的质量比______.