题目内容
(2013?雨花台区一模)某班化学实验课进行酸碱盐的性质实验.
【自制酸碱指示剂】
(1)取少量紫包菜和白菜叶剪碎后分别放在研钵中捣烂,加入酒精浸泡;用纱布将浸泡出的汁液挤出,分别装好待用.
(2)取四支试管分别用NaOH溶液和稀盐酸进行实验,观察到现象如图,记录如下:

你认为两种汁液中,更适合做酸碱指示剂的是
(3)再用苹果汁进行相同实验,现象记录见上表.则苹果汁溶液显
【酸碱盐的性质】
第一组学生进行CuSO4与NaOH溶液的反应,观察到的现象是
第二组学生进行BaCl2与Na2CO3溶液的反应,反应的方程式为
从复分解反应发生的微观本质上看,中和反应的实质可以用下图1表示,那么请在图2虚框中将CuSO4与NaOH溶液的反应的微观示意图补充完整.
【废液再探究】
实验结束后,两组同学将全部的浊液集中倒进一个废液缸中.化学兴趣小组对浊液进行过滤,得到无色滤液,进一步探究无色滤液的成分.
【提出问题】滤液里溶质除了NaCl外,还有什么物质?
【提出猜想】猜想①:BaCl2; 猜想②:Na2SO4; 猜想③:NaOH;猜想④:BaCl2、NaOH 猜想:⑤Na2CO3、Na2SO4
猜想:⑥Na2SO4、NaOH 猜想:⑦Na2CO3、Na2SO4和
【实验探究】
(1)取样,滴加紫包菜叶汁,显绿色,小军判断一定含NaOH,小华不同意,理由是
(2)取样,加入足量的稀硫酸,无明显现象,则猜想
(3)为确定该滤液的组成,还需补充的实验是:
【自制酸碱指示剂】
(1)取少量紫包菜和白菜叶剪碎后分别放在研钵中捣烂,加入酒精浸泡;用纱布将浸泡出的汁液挤出,分别装好待用.
(2)取四支试管分别用NaOH溶液和稀盐酸进行实验,观察到现象如图,记录如下:

| NaOH溶液 | 稀盐酸 | 苹果汁 | |
| 紫包菜汁液 | ①绿色 | ②红色 | 红色 |
| 白菜汁液 | ③无色 | ④淡黄色 | 淡黄色 |
紫包菜汁液
紫包菜汁液
.(3)再用苹果汁进行相同实验,现象记录见上表.则苹果汁溶液显
酸
酸
性.【酸碱盐的性质】
第一组学生进行CuSO4与NaOH溶液的反应,观察到的现象是
有蓝色沉淀
有蓝色沉淀
;第二组学生进行BaCl2与Na2CO3溶液的反应,反应的方程式为
BaCl2+Na2CO3═BaCO3↓+2NaCl
BaCl2+Na2CO3═BaCO3↓+2NaCl
.从复分解反应发生的微观本质上看,中和反应的实质可以用下图1表示,那么请在图2虚框中将CuSO4与NaOH溶液的反应的微观示意图补充完整.
【废液再探究】
实验结束后,两组同学将全部的浊液集中倒进一个废液缸中.化学兴趣小组对浊液进行过滤,得到无色滤液,进一步探究无色滤液的成分.
【提出问题】滤液里溶质除了NaCl外,还有什么物质?
【提出猜想】猜想①:BaCl2; 猜想②:Na2SO4; 猜想③:NaOH;猜想④:BaCl2、NaOH 猜想:⑤Na2CO3、Na2SO4
猜想:⑥Na2SO4、NaOH 猜想:⑦Na2CO3、Na2SO4和
NaOH
NaOH
【实验探究】
(1)取样,滴加紫包菜叶汁,显绿色,小军判断一定含NaOH,小华不同意,理由是
Na2CO3溶液也呈现碱性
Na2CO3溶液也呈现碱性
.(2)取样,加入足量的稀硫酸,无明显现象,则猜想
①④⑤⑦
①④⑤⑦
一定不成立.(3)为确定该滤液的组成,还需补充的实验是:
取样,加足量的BaCl2 溶液
取样,加足量的BaCl2 溶液
,若观察到白色沉淀,则该无色滤液的组成有Na2SO4、NaOH NaCl
Na2SO4、NaOH NaCl
.分析:根据物质的性质进行分析,适合做酸碱指示剂的物质应该在酸性和碱性溶液中显示不同的颜色,酸碱盐的溶液间若能两两交换成分生成水、气体或是沉淀,则反应能够进行,据此解答即可.
解答:解:(2)紫包菜汁在酸性和碱性溶液中的颜色明显不同,比白菜汁更适合做酸碱指示剂,故填:紫包菜汁液;
(3)紫包菜汁液在稀盐酸中为红色,说明酸性溶液能使紫包菜汁液变红,在苹果汁中显示红色,故能说明苹果汁呈酸性,故填:酸;
【酸碱盐的性质】硫酸铜能与氢氧化钠反应生成氢氧化铜蓝色沉淀,故会观察到有蓝色沉淀生成,故填:有蓝色沉淀;
氯化钡能与碳酸钠反应生成碳酸钡白色沉淀和氯化钠,故填:BaCl2+Na2CO3═BaCO3↓+2NaCl;
硫酸铜与氢氧化钠的反应实质是铜离子与氢氧根离子结合生成了氢氧化铜沉淀,图示: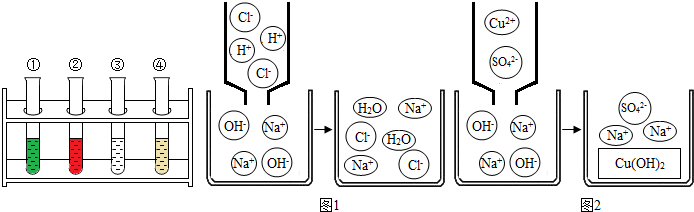
【提出猜想】⑦滤液为无色,则一定不会含有硫酸铜,反应生成的硫酸钠会与氯化钡反应生成硫酸钡沉淀,故硫酸钠与氯化钡不会同时存在,故猜想⑦可能是Na2CO3、Na2SO4和 NaOH,故填:NaOH;
【实验探究】(1)碳酸钠的水溶液呈碱性,也会使紫包菜汁液呈绿色,故不一定是氢氧化钠,故填:Na2CO3溶液也呈现碱性;
(2)稀硫酸能与氯化钡反应生成硫酸钡沉淀,能与碳酸钠反应生成二氧化碳,故含有氯化钡或是碳酸钠的猜想均不正确,故填:①④⑤⑦;
(3)溶液呈碱性,且加入一种试剂能产生白色沉淀,则可能是加入了氯化钡溶液,与硫酸钠反应生成了硫酸钡沉淀,故填:取样,加足量的BaCl2 溶液; Na2SO4、NaOH NaCl.
(3)紫包菜汁液在稀盐酸中为红色,说明酸性溶液能使紫包菜汁液变红,在苹果汁中显示红色,故能说明苹果汁呈酸性,故填:酸;
【酸碱盐的性质】硫酸铜能与氢氧化钠反应生成氢氧化铜蓝色沉淀,故会观察到有蓝色沉淀生成,故填:有蓝色沉淀;
氯化钡能与碳酸钠反应生成碳酸钡白色沉淀和氯化钠,故填:BaCl2+Na2CO3═BaCO3↓+2NaCl;
硫酸铜与氢氧化钠的反应实质是铜离子与氢氧根离子结合生成了氢氧化铜沉淀,图示:

【提出猜想】⑦滤液为无色,则一定不会含有硫酸铜,反应生成的硫酸钠会与氯化钡反应生成硫酸钡沉淀,故硫酸钠与氯化钡不会同时存在,故猜想⑦可能是Na2CO3、Na2SO4和 NaOH,故填:NaOH;
【实验探究】(1)碳酸钠的水溶液呈碱性,也会使紫包菜汁液呈绿色,故不一定是氢氧化钠,故填:Na2CO3溶液也呈现碱性;
(2)稀硫酸能与氯化钡反应生成硫酸钡沉淀,能与碳酸钠反应生成二氧化碳,故含有氯化钡或是碳酸钠的猜想均不正确,故填:①④⑤⑦;
(3)溶液呈碱性,且加入一种试剂能产生白色沉淀,则可能是加入了氯化钡溶液,与硫酸钠反应生成了硫酸钡沉淀,故填:取样,加足量的BaCl2 溶液; Na2SO4、NaOH NaCl.
点评:本题考查了酸碱指示剂的使用以及酸碱盐物质的判别及其有关的反应,完成此题,可以依据已有的知识进行.要求同学们熟练掌握常见物质的性质以及反应时的有关现象,以便灵活应用.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目