题目内容
A、B、C、D四种化合物分别通过分解反应生成两种物质,如下所示(反应条件略去):
① A → B + M
② B → M + N
③ C → M + P
④ D → M + Q
在生成物中N被认为是最清洁的燃料,P是常温下为液态的金属,Q的水溶液跟硝酸银溶液反应生成一种不溶于稀硝酸的白色沉淀,试推断(用化学式表示):
(1)A是 ; B是 ;C是 ;D是 。
(2)写出②对应的化学方程式 ;写出Q的水溶液跟硝酸银溶液反应的化学方程式 ;反应类型为 。
(1)H2O2 H2O HgO KClO3 (2) 2H2O
 2H2↑+ O2↑ KCl+AgNO3
2H2↑+ O2↑ KCl+AgNO3 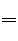
 KNO3 +AgCl↓ 复分解反应
KNO3 +AgCl↓ 复分解反应
解析:由题意知N为H2,P为Hg,Q的水溶液中含有氯离子。由③反应生成Hg可知,③为HgO的分解反应,M为O2,因此②为电解水的反应,①为过氧化氢分解制取氧气的反应 ,④为氯酸钾分解制取氧气的反应。
,④为氯酸钾分解制取氧气的反应。

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
在宏观、微观和符号之间建立联系是化学学科特点.
(1)镁条在空气中燃烧时,不仅生成氧化镁和氮化镁,还有少量镁与二氧化碳反应生成碳单质和氧化镁的反应发生.
①已知氮化镁中氮元素的化合价为-3价,氮化镁的化学式为 .
②写出镁与二氧化碳反应的化学方程式 .
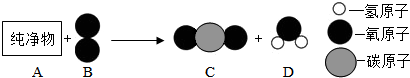
(2)若用 表示A元素的原子,
表示A元素的原子, 表示B元素的原子.某反应前后的物质微观示意图如下.
表示B元素的原子.某反应前后的物质微观示意图如下.
请回答下列问题.
①属于单质的物质是(填化学式,元素符号用A、B表示) .
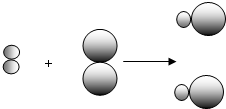
② 和
和 中的
中的 属于同种元素,这是因为这些原子含有相同的 .
属于同种元素,这是因为这些原子含有相同的 .
③该反应前后一定不变的是 (填序号).
a.原子数目 b.元素种类 c.分子种类 d.物质总质量
(3)在一个在密闭容器中放入A、B、C、D四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下:
若A与C的相对分子质量之比为15:16,则A与C的化学计量系数之比为 .
(1)镁条在空气中燃烧时,不仅生成氧化镁和氮化镁,还有少量镁与二氧化碳反应生成碳单质和氧化镁的反应发生.
①已知氮化镁中氮元素的化合价为-3价,氮化镁的化学式为 .
②写出镁与二氧化碳反应的化学方程式 .
(2)若用
 表示A元素的原子,
表示A元素的原子, 表示B元素的原子.某反应前后的物质微观示意图如下.
表示B元素的原子.某反应前后的物质微观示意图如下.
请回答下列问题.
①属于单质的物质是(填化学式,元素符号用A、B表示) .
②
 和
和 中的
中的 属于同种元素,这是因为这些原子含有相同的 .
属于同种元素,这是因为这些原子含有相同的 .③该反应前后一定不变的是 (填序号).
a.原子数目 b.元素种类 c.分子种类 d.物质总质量
(3)在一个在密闭容器中放入A、B、C、D四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下:
| 物质 | A | B | C | D |
| 反应前质量 (g) | 20 | 2 | 22 | 1 |
| 反应后质量(g) | x | 2 | 14 | 24 |
 表示A元素的原子,
表示A元素的原子, 表示B元素的原子.某反应前后的物质微观示意图如下.
表示B元素的原子.某反应前后的物质微观示意图如下.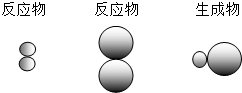
 和
和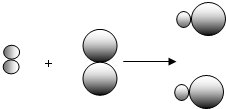 中的
中的 属于同种元素,这是因为这些原子含有相同的
属于同种元素,这是因为这些原子含有相同的